1
CAST investigators:N Engl J Med.1989;321(6):406-412
2
田中孝典ほか:新薬と臨牀.2004;53(7):831-835
3
高畠利一ほか:薬理と治療.1989;17(7):3195-3205
4
社内資料:生物学的同等性試験(カプセル25mg)
不整脈治療剤
1カプセル 23.6円
有効成分 | 1カプセル中 |
|---|---|
有効成分 | 日局 ピルシカイニド塩酸塩水和物 25mg |
添加剤 | 乳糖水和物、トウモロコシデンプン、ヒドロキシプロピルセルロース、ステアリン酸マグネシウム カプセル本体:青色1号、酸化チタン、ラウリル硫酸ナトリウム、ゼラチン |
有効成分 | 1カプセル中 |
|---|---|
有効成分 | 日局 ピルシカイニド塩酸塩水和物 50mg |
添加剤 | 乳糖水和物、トウモロコシデンプン、ヒドロキシプロピルセルロース、ステアリン酸マグネシウム カプセル本体:青色1号、酸化チタン、ラウリル硫酸ナトリウム、ゼラチン |
| 剤形 | 硬カプセル剤であり、内容物は白色の粉末又は粒状である。 |
|---|---|
| 色調 | 頭部が青色の不透明、胴部が白色の不透明 |
| 外形 | 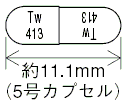 |
| 質量 | 約111mg |
| 識別コード | Tw413 |
| 剤形 | 硬カプセル剤であり、内容物は白色の粉末又は粒状である。 |
|---|---|
| 色調 | 頭部が青色の不透明、胴部が白色の不透明 |
| 外形 | 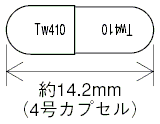 |
| 質量 | 約205mg |
| 識別コード | Tw410 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
リファンピシン | 本剤の作用を減弱させることがある。 | リファンピシンによりチトクロームP450の産生が誘導され、本剤の代謝速度が促進し、血中濃度が低下する可能性が考えられている。 |
カルシウム拮抗薬 ベラパミル β-受容体遮断薬 プロプラノロール ジギタリス製剤 ジゴキシン 硝酸・亜硝酸エステル系薬剤 ニトログリセリン | 動物実験(イヌ)において、本剤の作用が増強される可能性が報告されている。 | 機序は明らかではないが、作用増強の可能性が考えられている。 |
セチリジン | 両剤の血中濃度が上昇し、本剤の副作用が発現したとの報告がある。 | 腎でのトランスポーターを介した排泄が競合するためと考えられている。 |
0.1~5%未満 | 頻度不明 | |
|---|---|---|
循環器 | QRS幅の増大、QT延長、房室ブロック、洞房ブロック、胸部不快感、動悸、心室性期外収縮、上室性期外収縮、心房細動、上室性頻拍 | 胸痛、徐脈、心房粗動、血圧低下 |
消化器 | 胃痛、悪心、嘔吐、口渇、下痢、腹部不快感 | 便秘、食欲不振 |
精神神経系 | めまい、頭痛、眠気 | 振戦、不眠、しびれ |
血液 | 好酸球増加、リンパ球減少 | 白血球数減少、血小板数減少 |
肝臓 | AST上昇、ALT上昇、LDH上昇 | |
過敏症 | 発疹、蕁麻疹 | そう痒感 |
腎臓 | BUN上昇、クレアチニン上昇、尿蛋白陽性 | |
泌尿器 | 排尿困難 | |
その他 | 全身倦怠感、CK上昇、脱力感 | 熱感 |
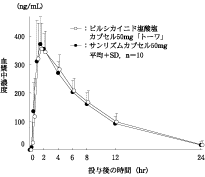
判定パラメータ | 参考パラメータ | |||
AUC0-24 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | t1/2 (hr) | |
ピルシカイニド塩酸塩 カプセル50mg「トーワ」 | 3203±673 | 397.3±92.4 | 1.80±0.86 | 5.16±0.85 |
サンリズムカプセル50mg | 3120±535 | 407.6±81.3 | 1.55±0.37 | 5.21±0.88 |
腎機能CLcr (mL/min/1.48m2) | 例数 | Tmax (hr) | Cmax (μg/mL) | t1/2 (hr) | Vd (L/kg) | CLtot (mL/min) |
CLcr≧80 | 6 | 3.1±0.6 | 0.41±0.08 | 3.4±0.2 | 1.48±0.19 | 280.0±37.5 |
80>CLcr≧50 | 10 | 2.7±0.8 | 0.46±0.03 | 5.7±0.3 | 1.46±0.11 | 182.8±11.8 |
50>CLcr≧20 | 8 | 3.1±0.8 | 0.51±0.05 | 9.3±1.1 | 1.70±0.15 | 123.4±19.3 |
20>CLcr | 8 | 3.8±0.7 | 0.63±0.05 | 23.7±2.0 | 1.46±0.11 | 38.8±4.6 |
 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379