1
Nakajima M.,et al.:Br J Clin Pharmacol.1998;46:55-62
2
El Allaf D.,et al.:Br J Clin Pharmacol.1982;14:431-435
3
社内資料:生物学的同等性試験(カプセル50mg)
4
社内資料:生物学的同等性試験(カプセル100mg)
不整脈治療剤・糖尿病性神経障害治療剤
1カプセル 7.2円
有効成分 | 1カプセル中 |
|---|---|
有効成分 | 日局 メキシレチン塩酸塩 50mg |
添加剤 | 結晶セルロース、トウモロコシデンプン、ヒドロキシプロピルセルロース、ステアリン酸マグネシウムカプセル本体:赤色3号、黄色三二酸化鉄、酸化チタン、ラウリル硫酸ナトリウム、ゼラチン |
有効成分 | 1カプセル中 |
|---|---|
有効成分 | 日局 メキシレチン塩酸塩 100mg |
添加剤 | 結晶セルロース、トウモロコシデンプン、ヒドロキシプロピルセルロース、ステアリン酸マグネシウムカプセル本体:赤色3号、黄色三二酸化鉄、酸化チタン、ラウリル硫酸ナトリウム、ゼラチン |
| 剤形 | 硬カプセル 内容物は白色の粉末又は粒状である。 |
|---|---|
| 色調 | 頭部がうすい黄赤色、胴部がごくうすい黄褐色不透明 |
| 外形 |  |
| 質量 | 約120mg |
| 識別コード | Tw401 |
| 剤形 | 硬カプセル 内容物は白色の粉末又は粒状である。 |
|---|---|
| 色調 | 頭部がうすい黄赤色、胴部が白色不透明 |
| 外形 |  |
| 質量 | 約223mg |
| 識別コード | Tw402 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
リドカイン プロカインアミド キニジン アプリンジン カルシウム拮抗剤 β受容体遮断剤 | 本剤の作用が増強することがある。 | 両剤の陰性変力作用と変伝導作用が相加的又は相乗的に増強することがある。 |
アミオダロン | torsade de pointesを発現したとの報告がある。 | 機序不明。 |
胃排出能を抑制する薬剤 モルヒネ 等 | 本剤の吸収が遅延することがある。 | モルヒネ等により胃の運動が低下し、胃内容排出時間が延長すると、本剤の吸収が遅延することがある。 |
肝薬物代謝酵素機能(特にチトクロームP-450系のCYP1A2及び2D6)に影響を与える薬剤 | 本剤の血中濃度に影響を与えるおそれがある。 | チトクロームP-450(CYP1A2、2D6)による本剤の代謝が影響を受けるおそれがある。 |
シメチジン | 本剤の血中濃度が上昇することがある。 | シメチジンによりチトクロームP-450の薬物代謝が阻害され本剤の血中濃度が上昇することがある。 |
リファンピシン フェニトイン | 本剤の血中濃度が低下することがある。 | 本剤の代謝が促進されることがある。 |
テオフィリン | テオフィリンの血中濃度が上昇することがある。 | 本剤はテオフィリンに比べ、チトクロームP-450への親和性が強く、テオフィリンの代謝が抑制される。 |
尿のpHをアルカリ化させる薬剤 炭酸水素ナトリウム 等 | 本剤の血中濃度が上昇することがある。 | アルカリ性尿は、本剤の腎排泄を抑制する。 |
尿のpHを酸性化させる薬剤 塩化アンモニウム 等 | 本剤の血中濃度が低下することがある。 | 酸性尿は、本剤の腎排泄を促進する。 |
1~5%未満 | 1%未満 | 頻度不明 | |
|---|---|---|---|
循環器 | 動悸、徐脈 | 起立時めまい、QRS延長、血圧上昇、浮腫、胸部圧迫感、心房細動、低血圧 | |
消化器 | 食欲不振、消化不良、腹痛 | 胃・腹部不快感、便秘、下痢、腹部膨満感 | 悪心・嘔吐、胸やけ、口渇 |
精神神経系 | 振戦、めまい | 頭痛、不眠、耳鳴、眼振、複視 | しびれ感、眠気、いらいら感、発汗、意識障害、痙攣、譫妄、構音障害 |
過敏症 | 瘙痒感、発熱多形(滲出性)紅斑 | 全身発疹、蕁麻疹、紅斑 | |
肝臓 | 尿ウロビリノゲンの上昇 | ||
腎臓 | BUN、クレアチニンの上昇 | 腎機能障害 | |
血液 | 赤血球減少、 ヘマトクリット減少、好酸球増加症、リンパ球減少 | 白血球数異常、血色素量減少、血小板数異常、好中球増多、顆粒球減少 | |
泌尿器 | 排尿困難、尿失禁 | 尿閉 | |
その他 | 咳、血清カリウム、総コレステロールの上昇、ほてり | 咽頭異和感、にがみ、倦怠感、足のこわばり、脱力感、味覚異常 |
例数 | クレアチニン クリアランス (mL/min) | 血漿中濃度 (8日目) (μg/mL) | 血中濃度 半減期 (hr) | |
コントロール群 | 9 | >75 | 0.14±0.15 | 10.35±3.2 |
腎不全患者群 | 7 | 10~30 | 0.19±0.10 | 13.76±3.76 |
8 | <10 | 0.31±0.15 | 15.69±4.96 |
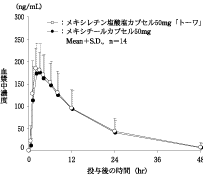
製剤投与量 (メキシレチン 塩酸塩として) | 判定パラメータ | 参考パラメータ | |||
AUC0-48 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | ||
メキシレチン塩酸塩 カプセル50mg「トーワ」 | 2カプセル (100mg) | 3044±1361 | 197.6±49.3 | 2.50±1.29 | 9.35±2.61 |
メキシチール カプセル50mg | 2カプセル (100mg) | 2880±1363 | 186.5±70.9 | 2.43±0.76 | 9.06±2.36 |
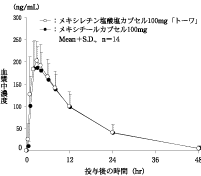
判定パラメータ | 参考パラメータ | |||
AUC0-48 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
メキシレチン塩酸塩 カプセル100mg「トーワ」 | 3128±944 | 215.2±46.8 | 2.36±0.93 | 8.54±1.35 |
メキシチール カプセル100mg | 3004±938 | 201.3±54.0 | 2.71±0.73 | 8.76±1.84 |
 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379