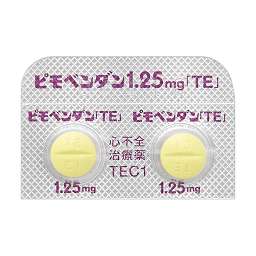
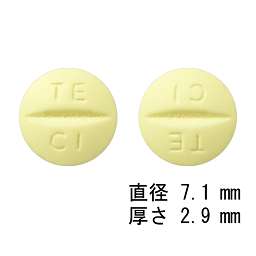
1
PICO Investigators:Heart.1996;76(3):223-231
2
仙田千晶ほか:薬理と治療.1992;20(5):1669-1684
3
重松昭生ほか:臨牀と研究.1991;68(7):2154-2172
4
東純一ほか:基礎と臨床.1992;26(3):1038-1062
5
東純一ほか:基礎と臨床.1992;26(4):1431-1455
6
角尾道夫ほか:臨牀と研究.1991;68(11):3515-3538
7
前田彰ほか:診療と新薬.2008;45(9):885-896
8
トーアエイヨー社内資料:0.625mg錠 生物学的同等性試験
9
林博史ほか:臨床医薬.1992;8(4):813-832
10
林博史ほか:Ther Res.1992;13(1):591-612
11
加藤和三ほか:臨床医薬.1992;8(6):1311-1351
12
谷口興一ほか:臨牀と研究.1992;69(5):1634-1642
13
加藤和三ほか:臨牀と研究.1991;68(11):3539-3551
14
加藤和三ほか:臨床医薬.1991;7(12):2643-2669
15
篠山重威ほか:臨牀と研究.1992;69(6):1921-1943
16
加藤和三ほか:臨牀と研究.1992;69(7):2275-2297
17
Fujino K,et al.:Circulation Research.1988;63(5):911-922
18
Lee JA,et al.:Clinical Science.1989;76(6):609-618
19
Brunkhorst D,et al.:Naunyn-Schmiedeberg’s Arch Pharmacol.1989;339(5):575-583
20
Fujimoto S and Matsuda T:J Pharmacol Exp Ther.1990;252(3):1304-1311
21
Verdouw PD,et al.:Eur J Pharmacol.1986;126(1-2):21-30
22
Berger C,et al.:Arzneimittel-Forschung.1985;35(11):1668-1673
23
van Meel JCA and Diederen W:J Cardiovasc Pharmacol.1989;14(Suppl.2):S1-6
24
Holubarsch C,et al.:J Cardiovasc Pharmacol.1989;14(Suppl.2):S13-17
25
Asanoi H,et al.:J Cardiovasc Pharmacol.1994;23(2):268-274
26
亀山智樹ほか:薬理と治療.1992;20(4):1339-1346
27
Baumann G,et al.:J Cardiovasc Pharmacol.1989;13(5):730-738