1
社内資料:ブリンゾラミドの代謝に関与するチトクロームP-450分子種の同定(2013年9月20日承認、CTD2.6.4.1)[20170354]
2
Volotinen M, et al.:Drug Metab. Dispos.2007;35(7):1135-1141[20160995]
3
Christensen MT, et al.:CLAO J. 1998;24(4):227-231[20161037]
4
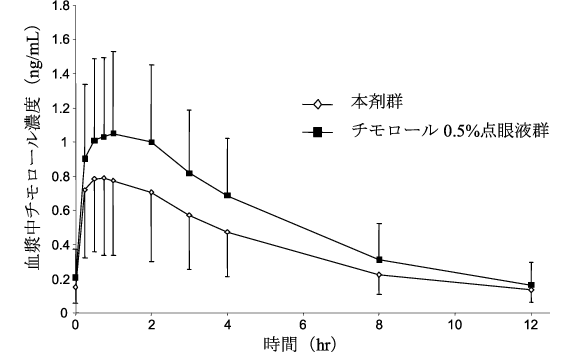
社内資料:日本人患者を対象とした臨床薬物動態試験(チモロール)(2013年9月20日承認、CTD2.7.2.2(1))[20170351]
5
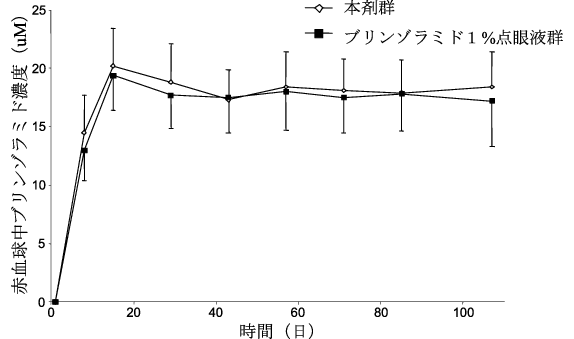
社内資料:日本人患者を対象とした臨床薬物動態試験(ブリンゾラミド)(2013年9月20日承認、CTD2.7.2.2(2))[20170352]
6
社内資料:外国人健康被験者を対象とした臨床薬物動態試験(ブリンゾラミド及びチモロール)(2013年9月20日承認、CTD2.7.2.3)[20170350]
7
社内資料:第Ⅲ相優越性試験(国内)(2013年9月20日承認、CTD2.7.6.1)[20170344]
8
社内資料:第Ⅲ相非劣性試験(国内)(2013年9月20日承認、CTD2.7.6.2)[20170345]
9
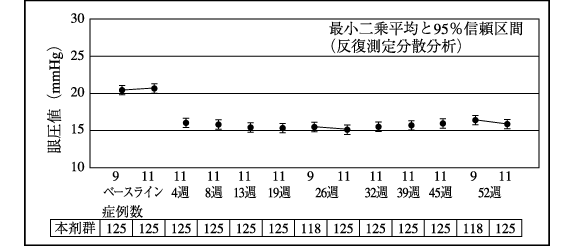
社内資料:第Ⅲ相長期投与試験(国内)(2013年9月20日承認、CTD2.7.6.3)[20170346]
10
中島正之:あたらしい眼科.1993;10(6):959-964[20160991]
11
Millar C, et al.:Duane’s Foundations of Clinical Ophthalmology/Tasman W, et al ed/Lippincott-Raven.1995;Vol.2, Chap.6:1-51[20160992]
12
Maren TH:J. Exp. Zool.1997;279(5):490-497[20160993]
13
佐藤清二:小児科診療.1991;54(7):1513-1520[20160994]
14
Miichi H, et al.:Invest. Ophthalmol. Vis. Sci.1983;24(9):1269-1275[20160987]
15
社内資料:高眼圧サルにおける眼圧下降作用(2013年9月20日承認、CTD2.4.2.1)[20170347]
16
社内資料:ヒトⅠ型及びⅡ型炭酸脱水酵素に対する結合能(2013年9月20日承認、CTD2.4.2.1)[20170348]
17
Vareilles P, et al.:Invest. Ophthalmol. Vis. Sci.1977;16(11):987-996[20160985]
18
Hall RA, et al.:Arch. Int. Pharmacodyn.1975;213(2):251-263[20160986]