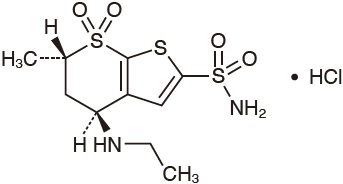
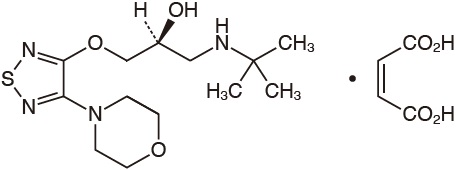
1
北澤克明 他:臨床医薬, 1993;9:1309-1325
2
)Korte JM, et al.: Graefes Arch Clin Exp Ophthalmol, 2002;240:430-435
3
コソプト配合点眼液:有色ウサギにおける眼組織分布試験(承認年月日:2010年4月16日、申請資料概要2.6.4.4)
4
原 健一 他:薬物動態, 1995;10:1-17
5
Hasegawa T, et al.:Drug Metab Dispos, 1994;22:377-382
6
Wong BK, et al.:ISSX Proceedings, 1995;8:140-140
7
Volotinen M, et al.:Drug Metab Dispos, 2007;35:1135-1141
8
コソプト配合点眼液:ヒト肝ミクロソームによるチモロールの代謝に及ぼすドルゾラミドの影響 (承認年月日:2010年4月16日、申請資料概要2.7.2.2)
9
北澤克明 他:日本眼科学会雑誌, 2011;115:495-507
10
Vanlandingham BD, et al.:Ophthalmology, 1998;105:1537-1540
11
中島正之:あたらしい眼科, 1993;10:959-964
12
Iester M:Clin Ophthalmol, 2008;2:517-523
13
Miichi H, et al.:Invest Ophthalmol Vis Sci, 1983;24:1269-1275
14
新家 真 他:日本眼科学会雑誌, 1980;84:1436-1446
15
藤永 豊 他:眼科臨床医報, 1980;74:409-414
16
玉田康房 他:日本眼科紀要, 1980;31:1667-1673
17
コソプト配合点眼液:サル及びウサギの高眼圧症モデル並びに正常眼圧ウサギにおける2%ドルゾラミド/0.5%チモロール点眼液を用いた効力を裏付ける試験(承認年月日:2010年4月16日、申請資料概要2.6.2.2)
18
Pedersen DB, et al.:Graefes Arch Clin Exp Ophthalmol, 2005;243:163-168
19
江見和雄:あたらしい眼科, 2001;18:255-257