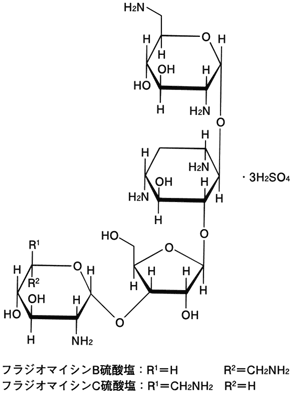
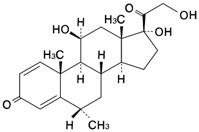
1
廣川書店:日本薬局方解説書 第十四改正.2001:C-3147
2
Lyster SC,et al.:Proc Soc Exp Biol Med.1957;94(1):159-162
眼科・耳鼻科疾患治療剤
1g 46.6円
有効成分 | 1g中 日局 フラジオマイシン硫酸塩 3.5mg(力価) 日局 メチルプレドニゾロン 1mg |
|---|---|
添加剤 | 精製ラノリン、白色ワセリン、流動パラフィン |
| 性状 | フラジオマイシン硫酸塩とメチルプレドニゾロンを油性基剤に調製混和した淡黄色半澄明の軟膏で無菌製剤である |
|---|
頻度不明 | |
|---|---|
耳・鼻 | 局所にフラジオマイシンの耐性菌又は非感性菌による化膿性の感染症 |
創傷 | 創傷治癒の遅延 |
下垂体・副腎皮質系 | 長期連用による下垂体・副腎皮質系機能の抑制 |
過敏症 | 眼瞼炎、結膜炎、刺激感 |
皮膚 | 接触皮膚炎 |
その他a) | 全身的使用の場合と同様な症状(腎障害等) |