1
東 純一:社内資料(単回点眼試験). 2004.(2011年9月26日承認、CTD2.7.6.1)
2
東 純一:社内資料(反復点眼試験). 2005.(2011年9月26日承認、CTD2.7.6.2)
3
笹辺裕行:社内資料(眼組織への分布試験). 2000.(2011年9月26日承認、CTD2.6.4.4)
4
Koyama, N. et al.:Xenobiotica. 2002;32(7):573-586.
5
佐渡一成:社内資料(後期第Ⅱ相試験). 2008.(2011年9月26日承認、CTD2.7.6.6)
6
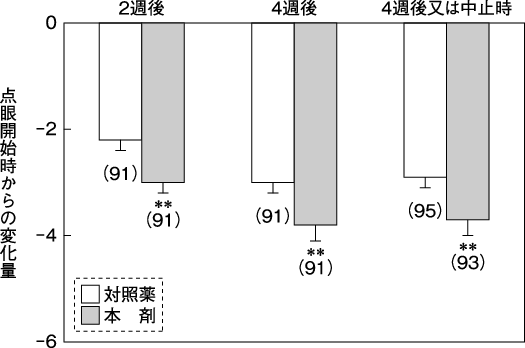
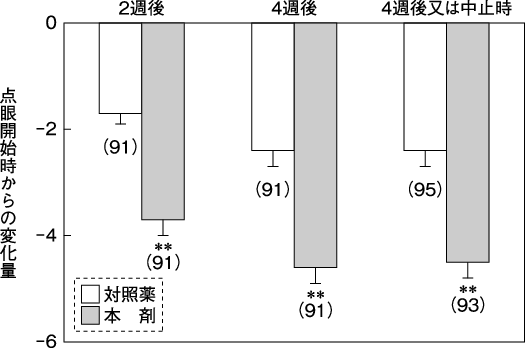
川北哲也:社内資料(第Ⅲ相試験). 2010.(2011年9月26日承認、CTD2.7.6.7)
7
佐渡一成:社内資料(52週間長期投与試験). 2010.(2011年9月26日承認、CTD2.7.6.12)
8
浦島博樹:社内資料(ムチン遺伝子発現作用). 2005.(2011年9月26日承認、CTD2.6.2.2)
9
浦島博樹:社内資料(ムチン増加作用). 2005.(2011年9月26日承認、CTD2.6.2.2)
10
竹治康広:社内資料(角膜上皮細胞増殖作用). 2000.(2011年9月26日承認、CTD2.6.2.2)
11
竹治康広:社内資料(結膜ゴブレット細胞数増加作用). 1998.(2011年9月26日承認、CTD2.6.2.2)
12
竹治康広:社内資料(ウサギ眼結膜ムチン増加作用). 1998.(2011年9月26日承認、CTD2.6.2.2)
13
Urashima, H. et al.:Cornea.2004;23(6):613-619.
14
浦島博樹:社内資料(ウサギ眼角膜ムチン増加作用). 2001.(2011年9月26日承認、CTD2.6.2.2)