1
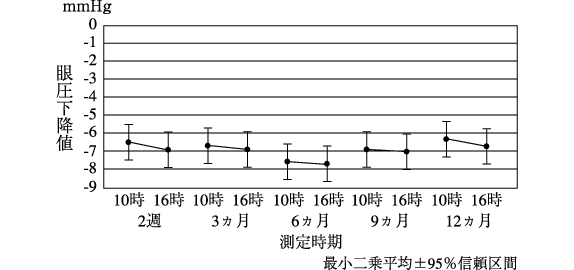
社内資料:トラボプロスト点眼液0.0015%の点眼回数による臨床効果[20170359]
2
Nagasubramanian S, et al.:Ophthalmol. 1993;100(9):1305-1311[20160976]
3
Stjernschantz JW, et al.:Surv. Ophthalmol. 2002;47(Suppl 1):S162-S175[20160977]
4
出光俊郎 他:臨床皮膚科. 2002;56(5増刊):158-160[20160978]
5
Maruyama K, et al.:J. Glaucoma. 2014;23(3):160-163[20160886]
6
社内資料:日本人健康成人を対象とした第Ⅰ相臨床薬物動態試験(2007年7月31日承認、CTD2.7.2.2)[20170372]
7
社内資料:外国人健康成人を対象とした第Ⅰ相臨床薬物動態試験(2007年7月31日承認、CTD2.7.2.2)[20170373]
8
社内資料:外国人健康成人及び肝機能障害者を対象とした第Ⅰ相臨床薬物動態試験(2007年7月31日承認、CTD2.7.2.2)[20170367]
9
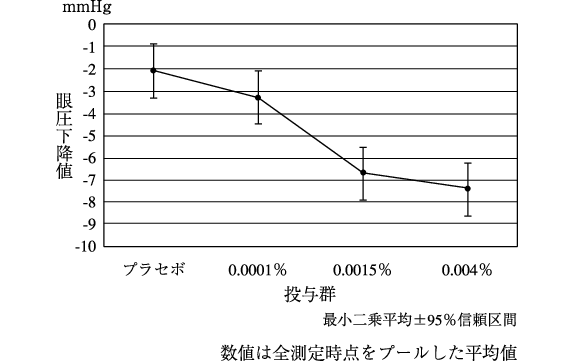
社内資料:日本人患者を対象とした第Ⅱ相用量反応試験(2007年7月31日承認、CTD2.7.3)[20170360]
10
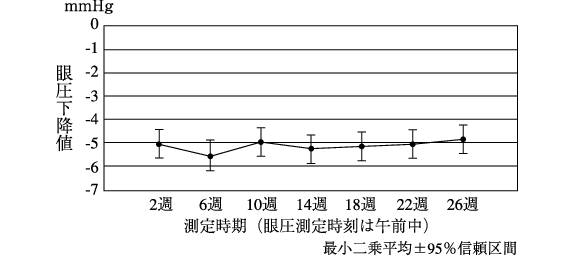
社内資料:日本人患者を対象とした第Ⅲ相臨床試験(国内)(2007年7月31日承認、CTD2.7.3)[20170361]
11
社内資料:日本人患者を対象とした第Ⅲ相臨床試験(海外)(2007年7月31日承認、CTD2.7.3)[20170362]
12
Netland PA, et al.:Am. J. Ophthalmol. 2001;132(4):472-484[20160875]
13
Orengo-Nania S, et al.:Am. J. Ophthalmol. 2001;132(6):860-868[20160979]
14
Lewis RA, et al.:J. Glaucoma. 2007;16(1):98-103[20160980]
15
Griffin BW, et al.:J. Pharmacol. Exp. Ther. 1997;281(2):845-854[20160981]
16
Hellberg MR, et al.:J. Ocul. Pharmacol. Ther. 2001;17(5):421-432[20160982]
17
Sharif NA, et al.:Eur. J. Pharmacol. 2001;432(2-3):211-213[20160983]
18
社内資料:高眼圧サルにおける眼圧下降作用(2007年7月31日承認、CTD2.6.2.2.2)[20170368]