1
Momose T, et al.:CLAO J. 1997;23(2):96-99[20161021]
2
Christensen MT, et al.:CLAO J. 1998;24(4):227-231[20161037]
3
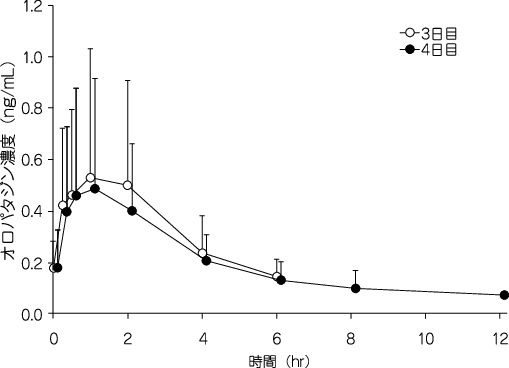
社内資料:アレルギー患者における血中濃度(2006年7月26日承認、申請資料概要ヘ-4(2))[20170245]
4
社内資料:後期第Ⅱ相試験(抗原誘発試験2)(2006年7月26日承認、申請資料概要ト-1(10))[20170241]
5
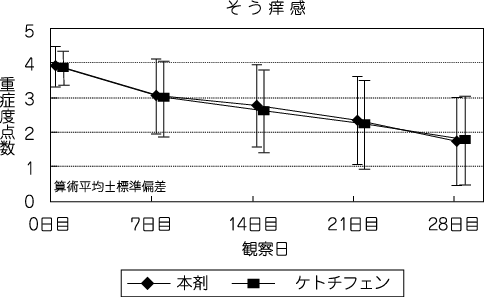
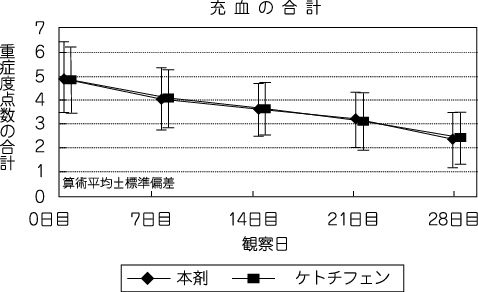
社内資料:第Ⅲ相試験1-フマル酸ケトチフェン点眼液との比較-(C-06-53試験)(2006年7月26日承認、申請資料概要ト-1(8))[20220104]
6
Sharif NA, et al.:J.Ocul.Pharmacol.Ther. 1996;12(4):401-407[20161039]
7
社内資料:作用機序(ヒスタミン受容体拮抗作用)(2006年7月26日承認、申請資料概要ホ-3)[20170243]
8
Yanni JM, et al.:Arch.Ophthalmol. 1999;117(5):643-647[20161022]
9
社内資料:作用機序(ヒト結膜肥満細胞からの炎症性伝達物質遊離へ及ぼす影響)(2006年7月26日承認、申請資料概要ホ-2)[20170244]
10
Cook EB, et al.:Ann.Allergy Asthma Immunol. 2000;84(5):504-508[20161023]
11
Yanni JM, et al.:J.Ocul.Pharmacol.Ther. 1996;12(4):389-400[20161024]