添付文書番号
1319743Q1041_3_04
企業コード
530113
作成又は改訂年月
日本標準商品分類番号
871319
承認等
販売名
ブロムフェナクNa点眼液0.1%「日新」
販売名コード
販売名英字表記
Bromfenac Na Ophthalmic Solution 0.1%「NISSIN」
販売名ひらがな
ぶろむふぇなくNaてんがんえき0.1%「にっしん」
承認番号等
販売開始年月
貯法、有効期間
基準名
一般的名称
ブロムフェナクナトリウム水和物
禁忌(次の患者には投与しないこと)
組成・性状
組成
ブロムフェナクNa点眼液0.1%「日新」
有効成分 | 1mL中
日本薬局方ブロムフェナクナトリウム水和物 1mg |
|---|
添加剤 | ポリソルベート80、ホウ酸、ホウ砂、ポビドン、エデト酸ナトリウム水和物、乾燥亜硫酸ナトリウム、ベンザルコニウム塩化物、pH調節剤 |
|---|
製剤の性状
ブロムフェナクNa点眼液0.1%「日新」
| pH | 8.0~8.6 |
|---|
| 浸透圧比 | 0.9~1.1(生理食塩液に対する比) |
|---|
| 性状 | 黄色澄明の水性点眼液(無菌製剤) |
|---|
効能又は効果
外眼部及び前眼部の炎症性疾患の対症療法〔眼瞼炎、結膜炎、強膜炎(上強膜炎を含む)、術後炎症〕
用法及び用量
重要な基本的注意
本剤による治療は原因療法ではなく対症療法であることに留意すること。
特定の背景を有する患者に関する注意
合併症・既往歴等のある患者
角膜上皮障害のある患者
角膜糜爛、さらに角膜潰瘍、角膜穿孔へと進行するおそれがある。
眼の感染による炎症のある患者
感染症を不顕性化するおそれがある。
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
小児等
低出生体重児又は新生児を対象とした臨床試験は実施していない。
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
角膜潰瘍、角膜穿孔(いずれも頻度不明)
角膜上皮障害等があらわれた場合には投与を中止し、適切な処置を行うこと。
その他の副作用
| 0.1~ 5 %未満 | 頻度不明 |
|---|
過敏症 | | 接触皮膚炎 |
|---|
眼 | 結膜炎、眼瞼炎、刺激感、眼痛[一過性] | 角膜糜爛、熱感[眼瞼]、点状表層角膜炎、角膜上皮剝離、そう痒感 |
|---|
適用上の注意
薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
患眼を開瞼して結膜嚢内に点眼し、1 ~ 5 分間閉瞼して涙嚢部を圧迫させた後、開瞼すること。
他の点眼剤を併用する場合には、少なくとも5 分以上間隔をあけてから点眼すること。
その他の注意
臨床使用に基づく情報
外国において、ブロムフェナクナトリウムの経口剤を1 ヵ月以上の長期にわたり総投与量として1,500mg以上投与した患者に重篤な肝障害(死亡を含む)が認められたとの報告があることから、肝障害の初期症状に関連すると考えられる異常所見が認められた場合は投与を中止し、適切な処置を行うこと。
薬物動態
PharmacokineticsEtc
生物学的同等性試験
ウサギ眼組織内薬物移行動態
ブロムフェナクNa点眼液0.1%「日新」とブロナック点眼液0.1%について、ウサギの左眼にはブロムフェナクNa点眼液0.1%「日新」を、右眼にはブロナック点眼液0.1%をそれぞれ50μL(ブロムフェナクナトリウム水和物として0.05mg)点眼し、房水中のブロムフェナクナトリウム濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)~log(1.25)の範囲内であり、両製剤の生物学的同等性が確認された 。
薬効薬理
生物学的同等性試験
実験的急性結膜浮腫に対する抑制効果
ブロムフェナクNa点眼液0.1%「日新」とブロナック点眼液0.1%について、ラットの右眼にそれぞれ5μL(ブロムフェナクナトリウム水和物として0.005mg)点眼し、点眼15分後にカラゲニンによる実験的急性結膜浮腫を惹起させ浮腫抑制率を算出したところ、生理食塩液及びブロムフェナクNa点眼液0.1%「日新」の基剤と比較して両製剤とも同様の有意な抑制効果が認められた。また、統計解析を行った結果、両製剤の浮腫抑制効果に有意差は認められず、両製剤の生物学的同等性が確認された 。
房水蛋白濃度増加に対する抑制効果
ブロムフェナクNa点眼液0.1%「日新」とブロナック点眼液0.1%について、ウサギの右眼にそれぞれ50μL(ブロムフェナクナトリウム水和物として0.05mg)点眼し、点眼1時間後に前房穿刺し、刺激により増加する房水蛋白濃度の抑制率を算出したところ、生理食塩液及びブロムフェナクNa点眼液0.1%「日新」の基剤と比較して両製剤とも同様の有意な抑制効果が認められた。また、統計解析を行った結果、両製剤の房水蛋白濃度増加抑制効果に有意差は認められず、両製剤の生物学的同等性が確認された 。
有効成分に関する理化学的知見
一般的名称
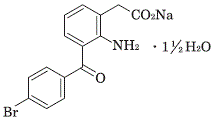
ブロムフェナクナトリウム水和物(Bromfenac Sodium Hydrate)
化学名
Sodium 2-[2-amino-3-(4-bromobenzoyl)phenyl]acetate sesquihydrate
分子式
C15H11BrNNaO3・1½H2O
分子量
383.17
性状
黄色~橙色の結晶性の粉末である。水に溶けやすく、メタノールにやや溶けやすく、エタノール(99.5)に溶けにくい。炭酸水素ナトリウム溶液(21→2500)に溶ける。
化学構造式
包装
主要文献
文献請求先及び問い合わせ先
製造販売業者等