1
社内資料:健康成人におけるブロムフェナクナトリウム点眼液の単回及び反復点眼試験(承認年月日:2000年3 月10日、申請資料概要ト 1. (1))
2
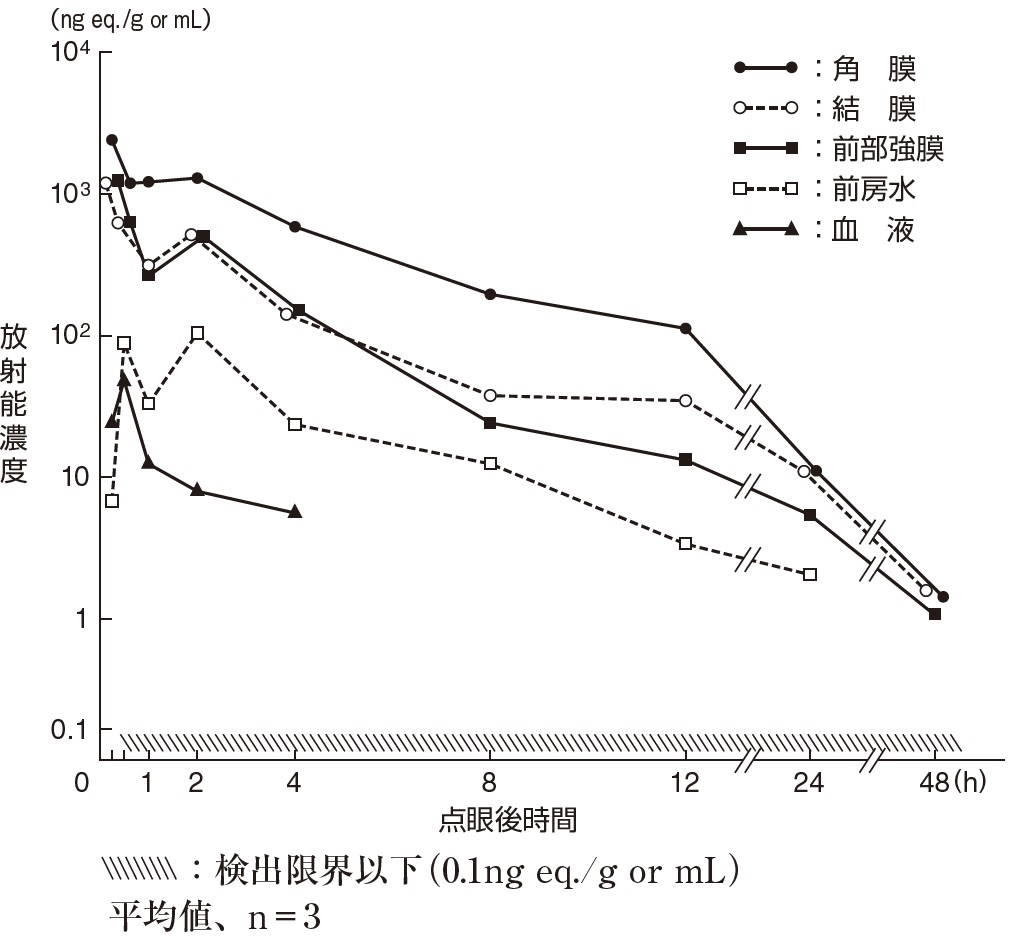
社内資料:ウサギにおけるブロムフェナクナトリウム水和物点眼液を点眼後の眼組織移行(承認年月日:2000年3 月10日、申請資料概要ヘ 2. (2)1))
3
社内資料:血漿タンパクとの結合(承認年月日:2000年3 月10日、申請資料概要ヘ 2. (2)4))
4
社内資料:尿及び糞への排泄(承認年月日:2000年3 月10日、申請資料概要ヘ 3. (4))
5
増田寛次郎 他:日本眼科紀要, 1997;48:560-569
6
社内資料:国内第Ⅲ相比較試験(外眼部炎症)(承認年月日:2000年3月10日、申請資料概要ト 1. (4)2))
7
小河貴裕 他:日本眼科学会雑誌, 1995;99:406-411