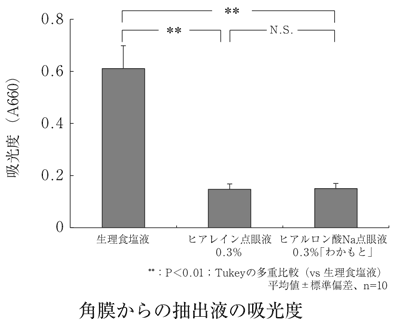
1
北野周作 他:日本眼科紀要. 1993;44:487-497
2
Nakamura M, et al.:J Cellular Physiol.1994;159:415-422
3
Nakamura M, et al.:Current Eye Res. 1994;13:385-388
4
Nakamura M, et al.:Cornea. 1993;12:433-436
5
中村雅胤 他:日本眼科紀要. 1995;46:1256-1260
6
Nakamura M, et al.:Current Eye Res. 1992;11:981-986
7
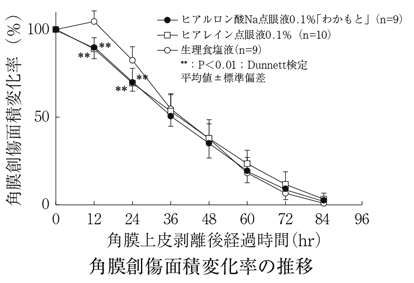
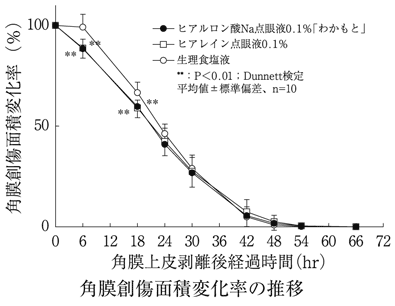
社内資料:生物学的同等性試験(0.1%製剤)
8
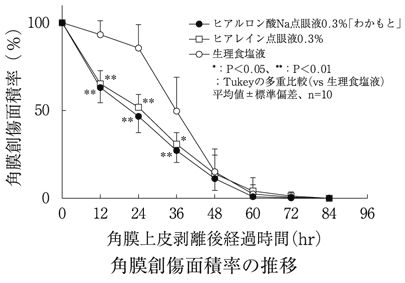
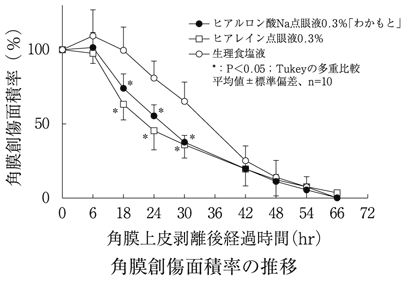
社内資料:生物学的同等性試験(0.3%製剤)