1
宇治幸隆ほか:眼科臨床医報.1980;74(8):1036-1042
2
Zimmerman,T.J.et al.:Arch.Ophthalmol.1984;102:551-553
3
第十八改正日本薬局方解説書(廣川書店).2021:C-3266
4
Araie,M.et al.:Jpn.J.Ophthalmol.1982;26(3):248-263
5
Volotinen M,et al.:Drug Metab Dispos.2007;35(7):1135-1141
6
Wasson B.K.et al.:J.Med.Chem.1980;23(11):1178-1184
7
Tocco.D.J.et al.:Drug Metab.Dispos.1975;3(5):361-370
8
北澤克明ほか:あたらしい眼科.1995;12(11):1793-1804
9
北澤克明ほか:あたらしい眼科.1996;13(1):143-154
10
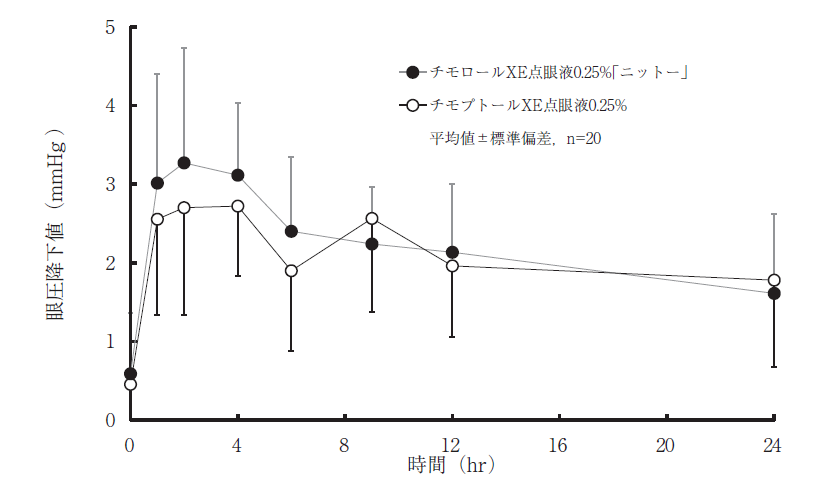
社内資料:チモロールXE点眼液0.25%「ニットー」の生物学的同等性試験
11
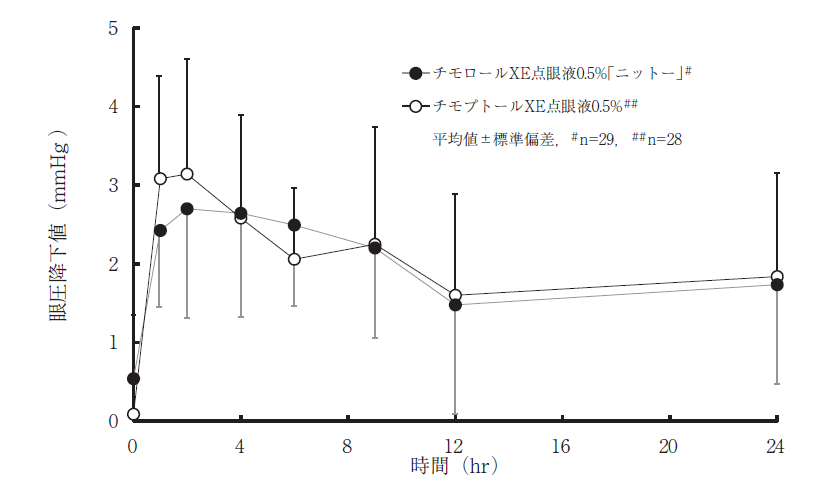
社内資料:チモロールXE点眼液0.5%「ニットー」の生物学的同等性試験
12
Miichi.H.et al.:Invest.Ophthalmol.Vis.Sci.1983;24(9):1269-1275
13
新家真ほか:日本眼科学会雑誌.1980;84(10):1436-1446
14
藤永豊ほか:眼科臨床医報.1980;74(4):409-414
15
玉田康房ほか:日本眼科紀要.1980;31(10):1667-1673
16
Vareilles,P.et al.:Invest.Ophthalmol.Vis.Sci.1977;16(11):987-996
17
Hall,R.A.et al.:Arch.Int.Pharmacodyn.1975;213:251-263
18
田辺堅三郎ほか:応用薬理.1979;17(3):455-467