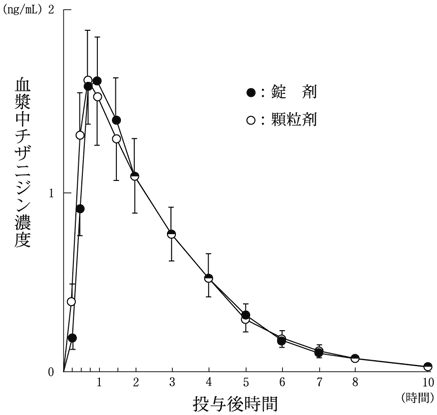
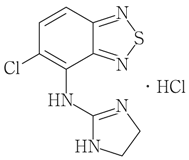
1
Kirch, W. et al.:In 3rd Europian Congr. Biopharmaceutics and Pharmacokinetics. Proc.1987;3:6-10
2
社内資料:国内一般臨床試験(頸肩腕症候群、腰痛症)に関する資料
3
山本龍二:診療と新薬.1993;30(1):107-115
4
田中 守:新薬と臨床.1993;42(2):283-288
5
青木虎吉ほか:医学のあゆみ.1986;136(4):311-326
6
社内資料:国内一般臨床試験(痙性麻痺)に関する資料
7
中島八十一:Prog. Med.1993;13(2):395-406
8
橋本朋子ほか:臨牀と研究.1993;70(6):1934-1944
9
社内資料:国内二重盲検試験(痙性麻痺)に関する資料