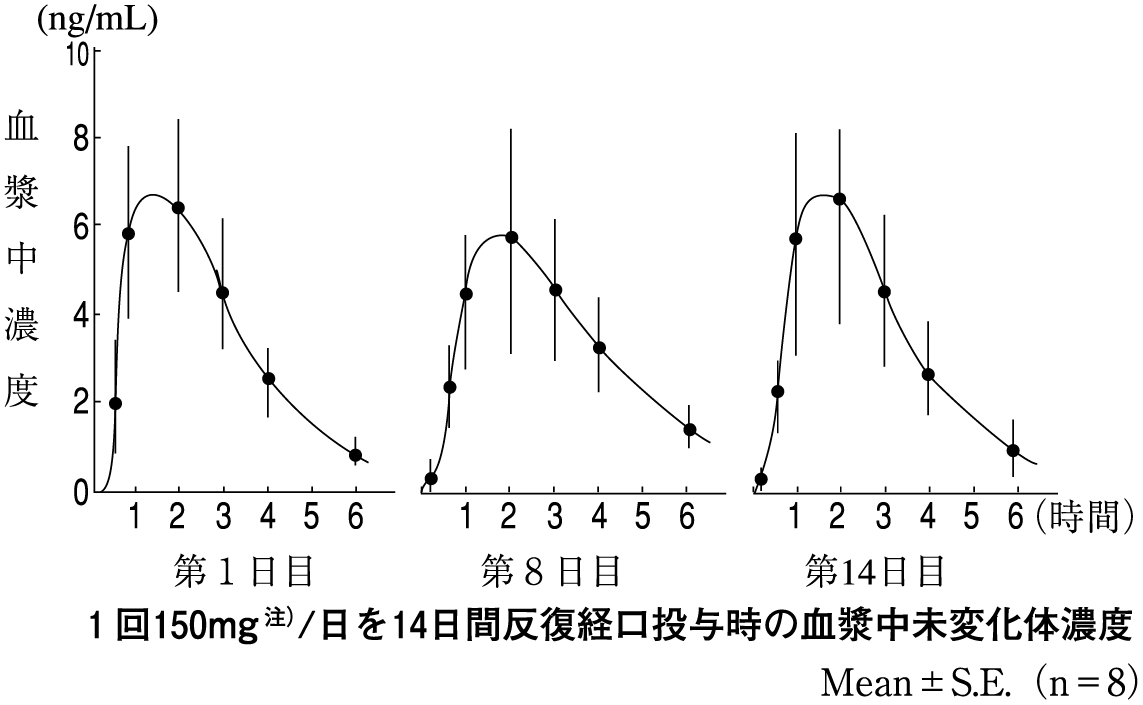
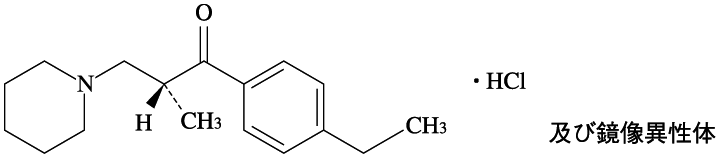
1
田中茂ら:基礎と臨床,1982;16(12):6423-6433[MYO-0046]
2
花井謙次ら:臨牀と研究,1983;60(6):2049-2053[MYO-0075]
3
多原哲治ら:Prog. Med.,1983;3(9):1703-1713[MYO-0077]
4
津山直一ら:臨床評価,1984;12(1):231-273[MYO-0069]
5
黒岩義五郎ら:臨床評価,1981;9(2):391-419[MYO-0055]
6
小林逸郎:診療と新薬,1982;19(6):1493-1505[MYO-0063]
7
東儀英夫ら:診療と新薬,1982;19(8):2073-2096[MYO-0057]
8
田中和夫ら:日本薬理学雑誌,1981;77(5):511-520[MYO-0032]
9
間野忠明ら:脳と神経,1981;33(3):237-241[MYO-0053]
10
Fujioka M. et al.:J. Pharmacol. Exp. Ther., 1985;235(3):757-763[MYO-0127]
11
Iwase S. et al.:Electroencepharol. Clin. Neurophysiol., 1987;66(5):1-7[MYO-0216]
12
本村喜代二ら:Biomed. Thermol., 1989;9(1):142-146[MYO-0203]
13
Shichino K. et al.:8th Asian Neurol. Satellite Sympo., 1992:83-94[MYO-0283]
14
杉本秀芳ら:基礎と臨床,1987;21(12):4882-4886[MYO-0168]
15
Mano T. et al.:8th Asian Neurol. Satellite Sympo., 1992:95-101[MYO-0284]
16
石突正文ら:日本整形外科学会雑誌,1989;63(7):S1238[MYO-0220]
17
渡辺誠介ら:臨牀と研究,1981;58(5):1610-1616[MYO-0052]






 127
127