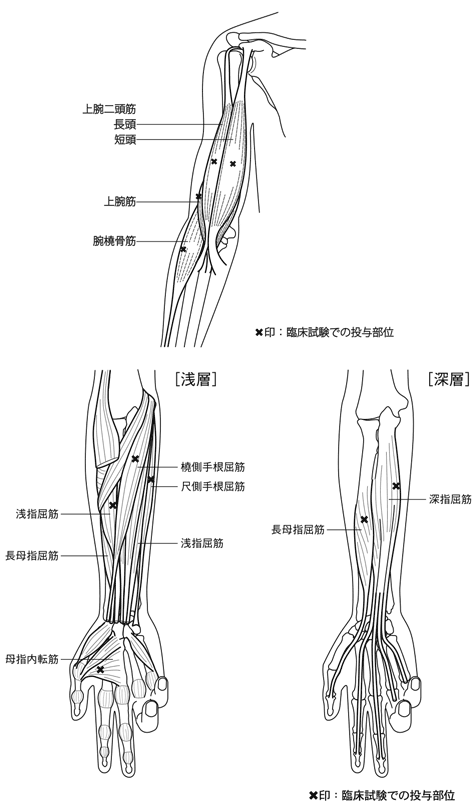
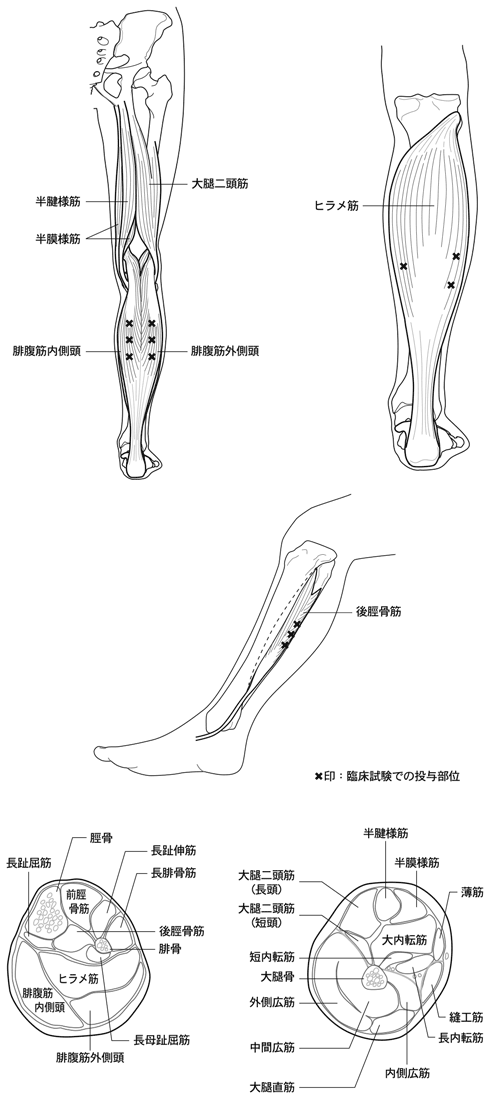
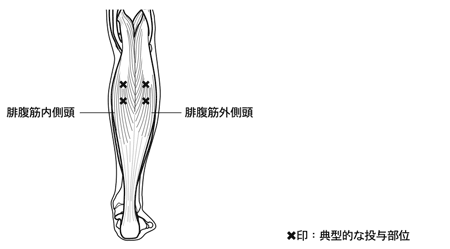
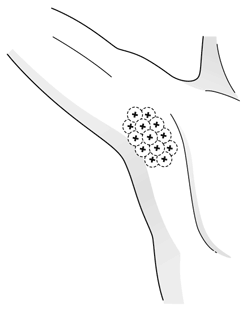
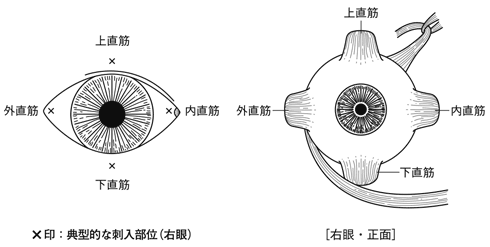
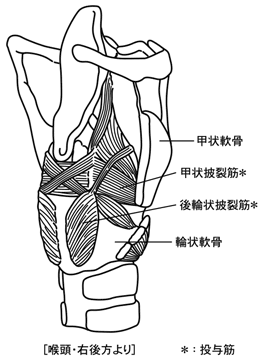
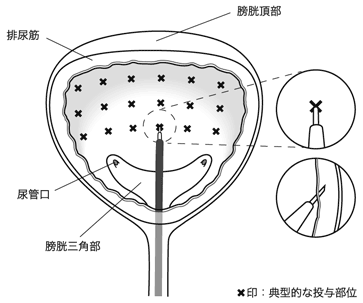
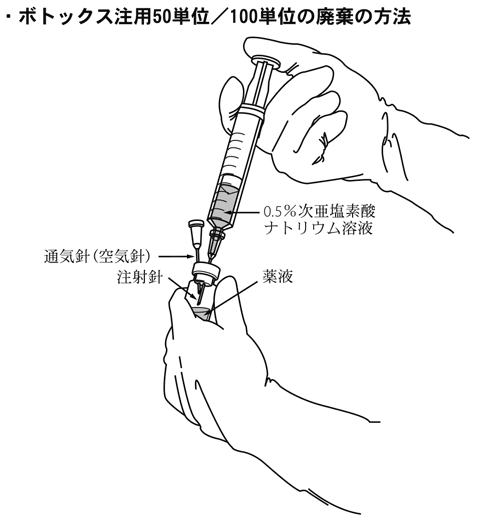
1
藤本智子ほか:日皮会誌.2015;125(7):1379-1400
2
「痙攣性発声障害の診断基準および重症度分類の策定に関する研究」班:痙攣性発声障害 診断基準および重症度分類.http://www.jslp.org/index.htm
3
社内資料:毒性試験(2019年12月20日承認、CTD2.6.6.9.1.2)
4
社内資料:分布・排泄に関する試験
5
岩重博康ほか:日眼会誌.1995;99(6):663-668
6
丸尾敏夫ほか:眼科臨床医報.1995;89(3):340-344
7
目崎高広ほか:脳と神経.1999;51(5):427-432
8
目崎高広ほか:脳と神経.1995;47(8):749-754
9
目崎高広ほか:脳と神経.1995;47(9):857-862
10
Kaji R,et al.:Curr Med Res Opin. 2010;26(8):1983-1992
11
Abo M,et al.:Toxins.2020;12(2):127
12
Kaji R,et al.:J Neurol. 2010;257(8):1330-1337
13
大嶋雄一郎ほか:西日皮膚.2013;75(4):357-364
14
Yokoyama O,et al.:Int J Urol.2020;27(3):227-234
15
Campanati A,et al.:Clin Ther.2003;25(1):298-308
16
社内資料:薬効薬理試験
17
Aoki KR,et al.:Eur J Neurol.1995;2:3-9
18
社内資料:薬効薬理試験