1
Nakamaru Y,et al.:Clin Ther.2020 Sep;42(9):1699-1714
2
Nakamaru Y,et al.:Clin Ther.2020 Aug;42(8):1467-1482.e4
3
第十七改正日本薬局方解説書,C-833,廣川書店(2016)
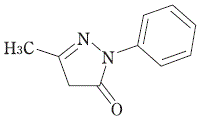
脳保護剤(フリーラジカルスカベンジャー)
1管 913円
有効成分 | 日本薬局方エダラボン 30mg (1管20mL中) |
|---|---|
添加剤 | 亜硫酸水素ナトリウム20mg、クエン酸水和物50mg、塩化ナトリウム150mg、水酸化ナトリウム、リン酸(1管20mL中) |
| pH | 3.8~4.5 |
|---|---|
| 浸透圧比 | 0.9~1.1(生理食塩液に対する比) |
| 性状 | 無色澄明の液(水性注射剤) |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
抗生物質 (セファゾリンナトリウム、セフォチアム塩酸塩、ピペラシリンナトリウム等) | 腎機能障害が増悪するおそれがあるので、併用する場合には頻回に腎機能検査を実施するなど観察を十分に行うこと。 | 機序は不明であるが、本剤は主として腎臓から排泄されるため、腎排泄型の抗生物質との併用により、腎臓への負担が増強する可能性が考えられる。 |
5%以上 | 0.1~5%未満 | 頻度不明 | |
|---|---|---|---|
過敏症 | 発疹、腫脹、紅斑(多形滲出性紅斑等) | 発赤、膨疹、そう痒感 | |
血液 | 赤血球減少、白血球増多、白血球減少、ヘマトクリット値減少、ヘモグロビン減少、血小板増加、血小板減少 | ||
注射部位 | 注射部発疹、注射部発赤腫脹 | ||
肝臓 | ALT上昇 | 総ビリルビン値上昇、AST上昇、LDH上昇、ALP上昇、γ-GTP上昇、ビリルビン尿 | ウロビリノーゲン陽性 |
腎臓 | BUN上昇、血清尿酸上昇、血清尿酸低下、蛋白尿、血尿 | 多尿、クレアチニン上昇 | |
消化器 | 嘔気 | 嘔吐 | |
その他 | 発熱、血清コレステロール上昇、血清コレステロール低下、トリグリセライド上昇、血清総蛋白減少、CK上昇、CK低下、血清カリウム低下、尿中ブドウ糖陽性、熱感、血圧上昇、血清カルシウム低下 | 血清カリウム上昇、頭痛 |
薬物動態パラメータ | 軽度腎機能障害 | 中等度腎機能障害 | 腎機能正常 |
Cmax(ng/mL) | 545.4±92.59 | 593.2±115.4 | 475.9±95.32 |
AUC0-∞(ng・h/mL) | 771.0±153.6 | 826.4±149.4 | 644.9±153.1 |
t1/2(h) | 5.38±6.04 | 7.31±5.83 | 2.87±0.38 |
薬物動態パラメータ | 重度肝機能障害 | 肝機能正常 |
Cmax(ng/mL) | 347.6±146.8 | 280.3±101.0 |
AUC0-∞(ng・h/mL) | 497.0±183.8 | 416.3±165.0 |
t1/2(h) | 3.88±1.12 | 9.51±6.62 |
薬物動態パラメータ | 軽度肝機能障害 | 中等度肝機能障害 | 肝機能正常 |
Cmax(ng/mL) | 538.1±182.3 | 533.4±88.57 | 429.0±44.36 |
AUC0-∞(ng・h/mL) | 727.6±262.0 | 751.5±148.3 | 654.3±107.2 |
t1/2(h) | 3.14±0.58 | 4.37±1.90 | 4.70±6.92 |