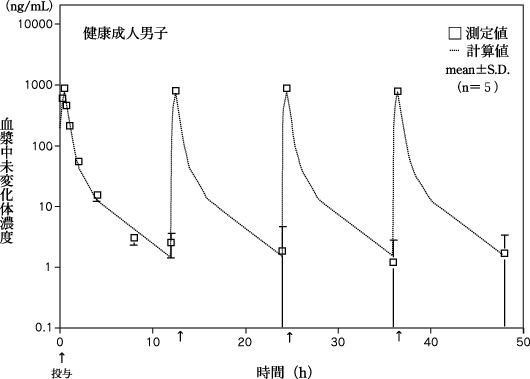
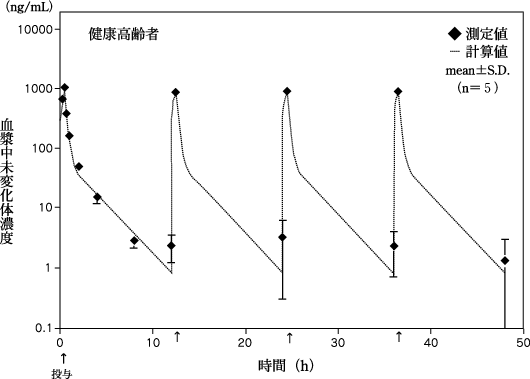
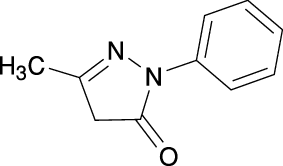
1
横田愼一, 他:臨床薬理. 1997;28(3):693-702
2
山本美奈子, 他:薬理と治療. 1997;25(Suppl.7):1755-1763
3
Nakamaru Y, et al.:Clin Ther. 2020 Sep;42(9):1699-1714
4
Nakamaru Y, et al.:Clin Ther. 2020 Aug;42(8):1467-1482.e4
5
大友英一, 他:Ther Res. 1998;19(4):1311-1332
6
MCI-186脳梗塞急性期研究会:医学のあゆみ. 1998;185(11):841-863
7
Otomo E, et al.:Cerebrovasc Dis. 2003;15(3):222-229
8
Houkin K, et al.:J Stroke Cerebrovasc Dis. 1998;7(5):315-322
9
三森研自, 他:Ther Res. 1998;19(4):1333-1345
10
田辺三菱製薬(株):検証的試験2回目(社内資料)(2015年6月26日承認、CTD2.7.6.1)
11
Abe K, et al.:Amyotroph Lateral Scler Frontotemporal Degener. 2014;15(7-8):610-617
12
田辺三菱製薬(株):ALS重症度分類3度の患者を対象とした探索的試験(社内資料)(2015年6月26日承認、CTD2.7.6.4)
13
Mizuno A, et al.:Gen Pharmacol. 1998;30(4):575-578
14
Yamamoto T, et al.:Brain Res. 1997;762(1-2):240-242
15
Abe K, et al.:Stroke. 1988;19(4):480-485
16
高松康雄, 他:薬理と治療. 1997;25(Suppl.7):1785-1791
17
Kawai H, et al.:J Pharmacol Exp Ther. 1997;281(2):921-927
18
Nishi H, et al.:Stroke. 1989;20(9):1236-1240
19
渡辺俊明, 他:薬理と治療. 1997;25(Suppl.7):1691-1698
20
Yamamoto Y, et al.:Redox Rep. 1996;2(5):333-338
21
Watanabe T, et al.:Prostaglandins Leukot Essent Fatty Acids. 1988;33(1):81-87
22
田辺三菱製薬(株):Effects of MCI-186 in superoxide dismutase(SOD)transgenic rats(amyotrophic lateral sclerosis model)(社内資料)(2015年6月26日承認、CTD2.6.2.2.3)