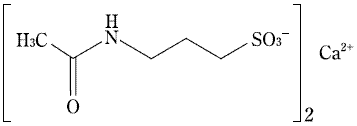
1
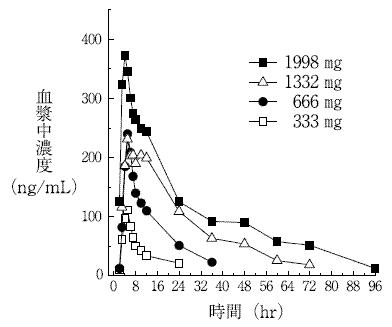
国内第Ⅰ相単回経口投与試験(承認年月日:2013年3月25日、CTD 2.7.6.3)
2
国内第Ⅰ相反復経口投与試験(承認年月日:2013年3月25日、CTD 2.7.6.4)
3
静脈内投与時の薬物動態及び排泄パラメータの検討(承認年月日:2013年3月25日、CTD 2.7.6.7)
4
単回及び反復経口投与時の薬物動態及び絶対的BAの検討(承認年月日:2013年3月25日、CTD 2.7.6.6)
5
14C-アカンプロサートカルシウムのin vitroタンパク結合試験(承認年月日:2013年3月25日、CTD 2.7.2.2.1(2))
6
14C-アカンプロサートカルシウム投与後のヒト代謝物の検討(承認年月日:2013年3月25日、CTD 2.7.2.2.1(3))
7
In vitroにおけるヒトチトクロームP-450(CYP)阻害及び酵素誘導試験(承認年月日:2013年3月25日、CTD 2.7.2.2.1(3))
8
腎障害患者における薬物動態の検討(承認年月日:2013年3月25日、CTD 2.7.6.15)
9
肝障害患者における薬物動態の検討(承認年月日:2013年3月25日、CTD 2.7.6.14)
10
国内第Ⅰ相高齢者反復経口投与試験(承認年月日:2013年3月25日、CTD 2.7.6.12)
11
国内第Ⅲ相試験(承認年月日:2013年3月25日、CTD 2.7.6.28)
12
グルタミン酸作動性神経活動に対する作用(承認年月日:2013年3月25日、CTD 2.6.2.2.1)
13
Dahchour A, et al. :Psychiatry Res. 1998;82(2):107-14
14
Dahchour A, et al. :Alcohol Clin Exp Res. 2003;27(3):465-70
15
De Witte P, :Addict Behav. 2004;29(7):1325-39
16
Gass JT, et al. :Biochem Pharmacol. 2008;75(1):218-65
17
Olive MF, et al. :Pharmacol Biochem Behav. 2012;100(4):801-10
18
エタノールの自発摂取に対する作用(承認年月日:2013年3月25日、CTD 2.6.2.2.3)
19
エタノールの報酬効果に対する作用(承認年月日:2013年3月25日、CTD 2.6.2.2.4)




 130
130