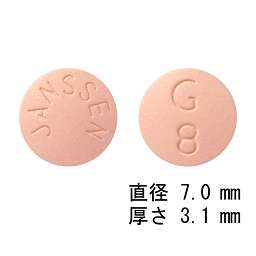
1
社内資料:ガランタミンとパロキセチンの相互作用の検討(2011年1月21日承認、CTD2.7.6.31)
2
社内資料:ガランタミンとエリスロマイシンの相互作用の検討(2011年1月21日承認、CTD2.7.6.30)
3
Zhao Q, et al.:J Clin Pharmacol. 2002; 42: 1002-1010
4
社内資料:ガランタミンの薬物動態の検討(2011年1月21日承認、CTD2.7.6.18)
5
社内資料:ガランタミンOD錠と錠剤の生物学的同等性試験(2011年1月21日承認、CTD2.7.6.16)
6
社内資料:ガランタミン内用液と錠剤の生物学的同等性試験(2011年1月21日承認、CTD2.7.6.15)
7
社内資料:ガランタミンの薬物動態に対する食事の影響試験(2011年1月21日承認、CTD2.7.6.11)
8
社内資料:ガランタミンの蛋白結合率の検討(2011年1月21日承認、CTD2.7.2.2)
9
社内資料:ガランタミンの代謝の検討(2011年1月21日承認、CTD2.7.2.2)
10
社内資料:ガランタミンの代謝酵素の検討(2011年1月21日承認、CTD2.7.2.2)
11
社内資料:ガランタミンの吸収,代謝及び排泄の検討(2011年1月21日承認、CTD2.7.6.19)
12
社内資料:高齢者におけるガランタミンの薬物動態の検討(2011年1月21日承認、CTD2.7.6.22)
13
Zhao Q, et al.:J Clin Pharmacol. 2002; 42: 428-436
14
社内資料:腎機能障害被験者におけるガランタミンの薬物動態の検討(2011年1月21日承認、CTD2.7.6.25)
15
社内資料:ガランタミンの国内二重盲検比較試験(2011年1月21日承認、CTD2.5.4)
16
社内資料:ガランタミンのコリンエステラーゼ阻害作用(2011年1月21日承認、CTD2.6.2.2.1.1)
17
社内資料:ガランタミンのラット脳内アセチルコリン濃度に対する作用(2011年1月21日承認、CTD2.6.2.2.2.1)
18
社内資料:ガランタミンのニコチン性アセチルコリン受容体に対する増強作用(2011年1月21日承認、CTD2.6.2.2.1.3)
19
Samochocki M, et al.:J Pharmacol Exp Ther. 2003; 305: 1024-1036
20
社内資料:ガランタミンの神経細胞保護作用(2011年1月21日承認、CTD2.6.2.2.1.4)
21
社内資料:ガランタミンのスナネズミ受動的回避学習試験に対する効果(2011年1月21日承認、CTD2.6.2.2.2.6)
22
社内資料:ガランタミンのスナネズミ能動的回避学習試験に対する効果(2011年1月21日承認、CTD2.6.2.2.2.7)