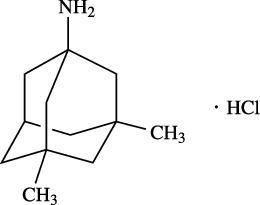
1
Freudenthaler S, et al.:Br J Clin Pharmacol. 1998;46(6):541-546
2
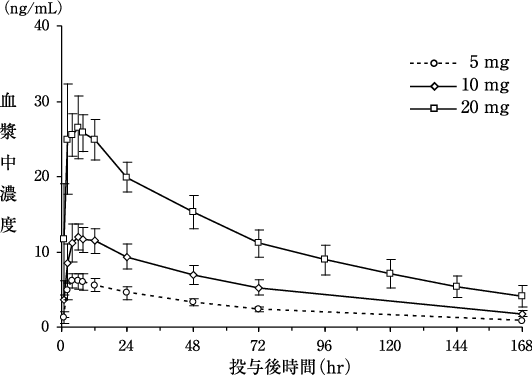
社内資料:健康成人男性における単回経口投与時の薬物動態の検討(2011年1月21日承認、CTD2.7.6.4)
3
社内資料:健康成人男性を対象としたフィルムコーティング錠及び口腔内崩壊錠の生物学的同等性試験
4
社内資料:アルツハイマー型認知症患者における反復経口投与時の薬物動態の検討(2011年1月21日承認、CTD2.7.6.7)
5
社内資料:ラットにおける14C-標識体を用いた乳汁中への移行(2011年1月21日承認、CTD2.6.4.6)
6
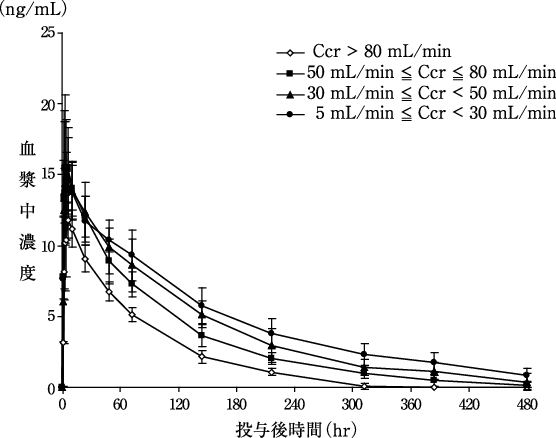
社内資料:腎機能障害患者における薬物動態の検討(2011年1月21日承認、CTD2.7.6.8)
7
社内資料:メマンチン塩酸塩とヒドロクロロチアジド・トリアムテレン配合剤との薬物動態学的相互作用の検討(2011年1月21日承認、CTD2.7.6.16)
8
北村 伸ほか:老年精神医学雑誌 2011;22(4):453-463
9
中村 祐ほか:老年精神医学雑誌 2011;22(4):464-473
10
Tariot PN, et al.:JAMA 2004;291(3):317-324
11
中村 祐ほか:Geriat Med. 2016;54(11):1147-1158
12
社内資料:メマンチン塩酸塩のドネペジル塩酸塩併用時における中等度及び高度アルツハイマー型認知症に対する製造販売後臨床試験
13
社内資料:NMDA受容体チャネル親和性の検討(2011年1月21日承認、CTD2.6.2.2)
14
Parsons CG, et al.:Neuropharmacology 1993;32(12):1337-1350
15
Frankiewicz T, et al.:Br J Pharmacol. 1996;117(4):689-697
16
Nakamura S, et al.:Eur J Pharmacol. 2006;548(1-3):115-122
17
Zajaczkowski W, et al.:Neuropharmacology 1997;36(7):961-971
18
Misztal M, et al.:Behav Pharmacol. 1995;6:550-561