1
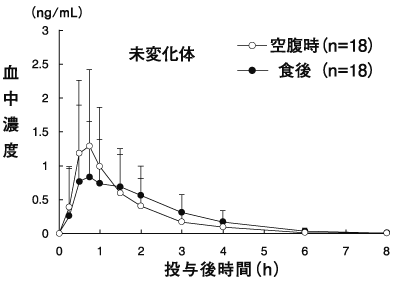
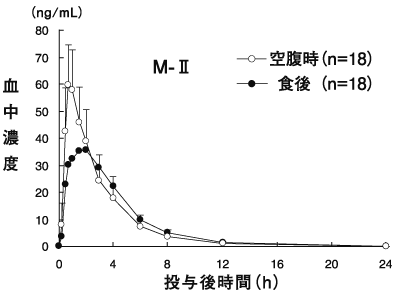
国内における薬物動態試験成績①(2010年4月16日承認:CTD2.7.6.2)
2
国内における薬物動態試験成績②(2010年4月16日承認:CTD2.7.6.5)
3
ラメルテオンの代謝に関する検討①(2010年4月16日承認:CTD2.7.2.2)
4
ラメルテオンの代謝に関する検討②(2010年4月16日承認:CTD2.6.2.2.3)
5
外国における薬物動態試験成績①(2010年4月16日承認:CTD2.7.6.7)
6
国内における薬物動態試験成績③(2010年4月16日承認:CTD2.7.6.10)
7
外国における薬物動態試験成績②(2010年4月16日承認:CTD2.7.6.12)
8
外国における薬物動態試験成績③(2010年4月16日承認:CTD2.7.6.13)
9
国内における臨床試験成績①(2010年4月16日承認:CTD2.7.6.31)
10
国内における臨床試験成績②(2010年4月16日承認:CTD2.7.6.32)
11
国内における臨床試験成績③(2010年4月16日承認:CTD2.7.6.33)
12
国内における臨床試験成績④(2010年4月16日承認:CTD2.7.6.43)
13
Kryger M. et al.:Sleep Breath. 2007;11:159-164.
14
Kato K, et al.:Neuropharmacology. 2005;48:301-310.
15
Yukuhiro N, et al.:Brain Research. 2004;1027:59-66.
16
Miyamoto M, et al.:Sleep. 2004;27(7):1319-1325.





 157
157