1
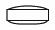
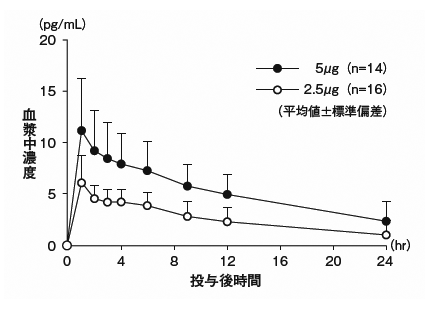
社内資料:血液透析患者における薬物動態の検討(2009年1月21日承認、CTD2.7.6)
2
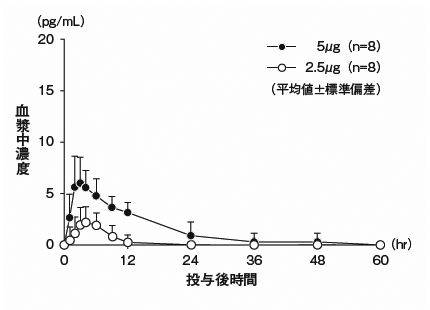
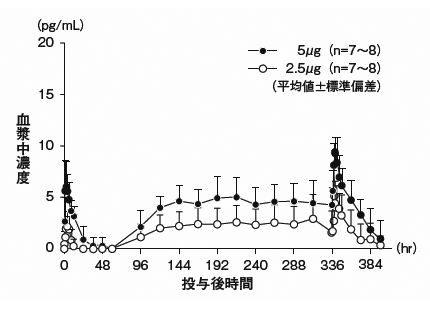
社内資料:腹膜透析患者における薬物動態の検討
3
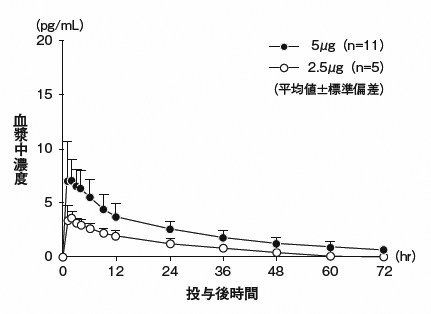
社内資料:代償性肝硬変患者における薬物動態の検討(2015年5月20日承認、CTD2.7.6)
4
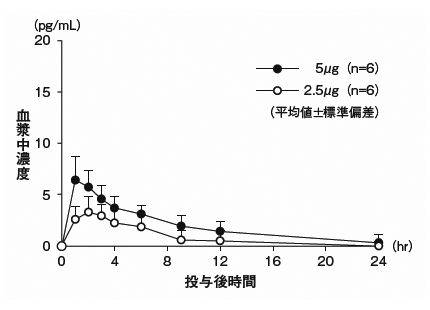
社内資料:Child-Pugh分類グレードBの肝硬変患者における薬物動態の検討
5
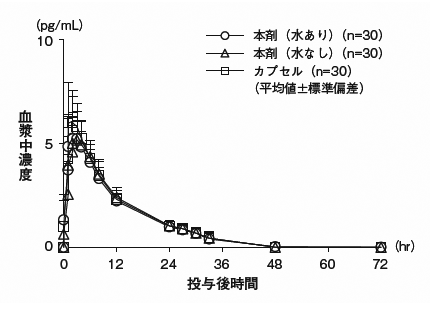
社内資料:健康成人におけるOD錠と軟カプセル剤の生物学的同等性の検討
6
社内資料:健康成人における食事の影響の検討(2009年1月21日承認、CTD2.7.6)
7
中尾薫 他:日本薬理学雑誌.2010;135(5):205-214
8
Ando, A. et al.:Biopharm. Drug Dispos. 2012;33(5):257-264
9
社内資料:健康成人における吸収、代謝、排泄の検討(2009年1月21日承認、CTD2.7.6)
10
社内資料:健康成人における薬物相互作用の検討(2009年1月21日承認、CTD2.7.6)
11
社内資料:薬物相互作用の検討
12
社内資料:非吸収性薬剤(吸着剤)との薬物相互作用の検討
13
社内資料:非吸収性薬剤(吸着剤)との薬物相互作用の検討(2)
14
社内資料:血液透析の影響
15
社内資料:血液透析患者におけるそう痒症に対する効果の検討(検証的試験)(2009年1月21日承認、CTD2.7.6)
16
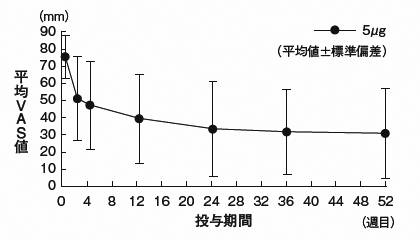
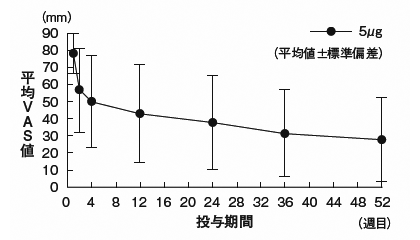
社内資料:血液透析患者におけるそう痒症に対する効果の検討(長期投与試験)(2009年1月21日承認、CTD2.7.6)
17
社内資料:腹膜透析患者におけるそう痒症に対する効果の検討(一般臨床試験)(2017年9月22日承認、CTD2.7.6)
18
社内資料:慢性肝疾患患者におけるそう痒症に対する効果の検討(検証的試験)(2015年5月20日承認、CTD2.7.6)
19
社内資料:慢性肝疾患患者におけるそう痒症に対する効果の検討(長期投与試験)(2015年5月20日承認、CTD2.7.6)
20
中尾薫 他:日本神経精神薬理学雑誌.2008;28(2):75-83
21
社内資料:各種受容体、トランスポーターおよびイオンチャンネルに対する結合試験
22
Umeuchi, H. et al.:Eur. J. Pharmacol. 2003;477(1):29-35
23
Togashi, Y. et al.:Eur. J. Pharmacol. 2002;435(2-3):259-264