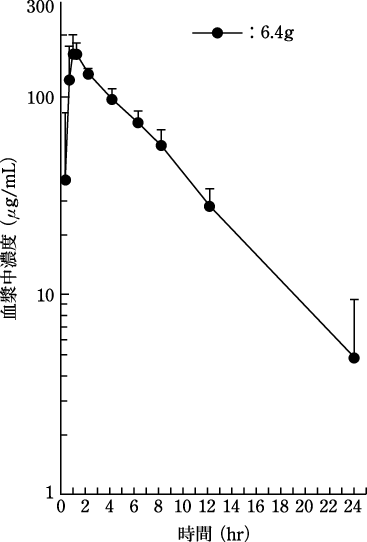
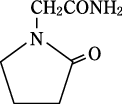
1
Bick R L, et al.:Int Symp on Nootropic Drugs Rio de Janeiro Oct 25-26. 1979;253-255
2
Moriau M, et al.:Arzneim-Forsch/Drug Res. 1993;43:110-118
3
Moriau M, et al.:Arzneim-Forsch/Drug Res. 1993;43:526-535
4
木下利彦 他:基礎と臨床 1996;30:2211-2229
5
池田昭夫 他:臨床医薬 1997;13:457-484
6
池田昭夫 他:臨床医薬 1997;13:485-500
7
Bering B, et al.:Arzneim-Forsch/Drug Res. 1985:35:1350-1352
8
Allikmets L H, et al.:Activ Nerv Sup. 1983;25:61-63
9
社内資料:尿素誘発ミオクローヌスに対するPiracetamの影響-ラットにおける電気生理学的研究