1
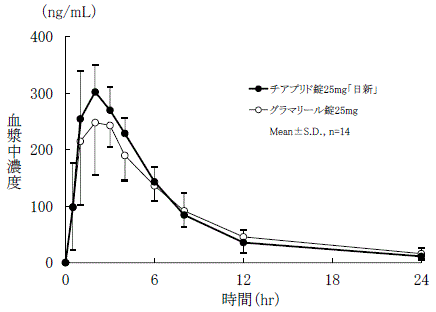
社内資料:生物学的同等性試験(錠25mg)
2
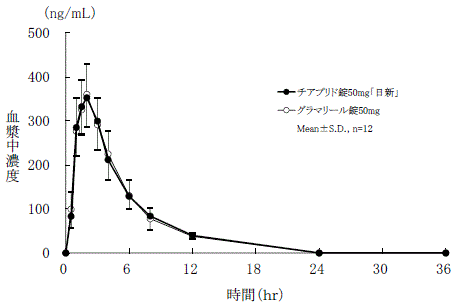
社内資料:生物学的同等性試験(錠50mg)
3
野口英世 他:基礎と臨床.1985;19(4):1977-1991
4
美川郁夫 他:基礎と臨床.1984;18(10):5357-5362
5
印東利勝 他:基礎と臨床.1984;18(11):5905-5912
6
本間昭 他:新薬と臨床.1985;34(1):17-26
7
第十八改正日本薬局方解説書.東京:廣川書店;2021.C3170-3173
1錠 7.9円
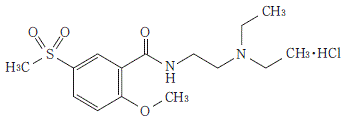
有効成分 | 1錠中 チアプリドとして 25mg日本薬局方チアプリド塩酸塩 27.8mg |
|---|---|
添加剤 | 乳糖水和物、結晶セルロース、ヒドロキシプロピルセルロース、トウモロコシデンプン、カルメロースカルシウム、タルク、ステアリン酸マグネシウム、ポリビニルアセタールジエチルアミノアセテート、マクロゴール、酸化チタン、沈降炭酸カルシウム、ヒプロメロース、カルナウバロウ |
有効成分 | 1錠中 チアプリドとして 50mg日本薬局方チアプリド塩酸塩 55.6mg |
|---|---|
添加剤 | 乳糖水和物、結晶セルロース、トウモロコシデンプン、ヒドロキシプロピルセルロース、ステアリン酸マグネシウム、ポリビニルアセタールジエチルアミノアセテート、タルク、マクロゴール、酸化チタン |
| 外形 |  |
|---|---|
| 大きさ | 錠径 6.1mm 錠厚 3.2mm 重量 100mg |
| 性状 | 白色~微帯黄白色のフィルムコーティング錠 |
| 本体表示 | N 3 |
| 外形 |  |
|---|---|
| 大きさ | 錠径 7.1mm 錠厚 3.5mm 重量 148mg |
| 性状 | 白色~微帯黄白色のフィルムコーティング錠 |
| 本体表示 | NS 165 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
QT延長を起こすことが知られている薬剤 ハロペリドール等 | QT延長、心室性不整脈等の重篤な副作用を起こすおそれがある。 | 本剤及びこれらの薬剤はいずれもQT間隔を延長させるおそれがあるため、併用により作用が増強するおそれがある。 |
ベンザミド系薬剤 メトクロプラミド スルピリド等 フェノチアジン系薬剤 クロルプロマジン等 ブチロフェノン系薬剤 ハロペリドール等 | 内分泌機能異常、錐体外路症状が発現しやすくなる。 | 本剤及びこれらの薬剤は抗ドパミン作用を有するため、併用により抗ドパミン作用が強くあらわれる。 |
ドパミン作動薬 レボドパ等 | 相互に作用を減弱させることがある。 | 本剤は抗ドパミン作用を有するため、作用が拮抗する。 |
中枢神経抑制剤 バルビツール酸誘導体 麻酔剤等 | 相互に中枢神経抑制作用を増強させることがある。 | 本剤及びこれらの薬剤は中枢神経抑制作用を有する。 |
アルコール 飲酒 | 相互に中枢神経抑制作用を増強させることがある。 | ともに中枢神経抑制作用を有する。 |
0.1~5%未満 | 0.1%未満 | |
|---|---|---|
循環器 | 不整脈、頻脈、胸内苦悶、血圧上昇、血圧低下 | |
錐体外路症状注) | パーキンソン症候群(振戦、筋強剛、運動減少、流涎、姿勢・歩行障害等)、ジスキネジア、言語障害、咬痙、アカシジア | ジストニア、嚥下障害 |
内分泌 | 乳汁分泌、女性化乳房、月経異常 | |
精神神経系 | 眠気、不眠、不安・焦燥、抑うつ、ぼんやり、性欲亢進 | |
自律神経系 | めまい・ふらつき、口渇、頭痛・頭重、脱力・倦怠感、しびれ、排尿障害、尿失禁、耳鳴 | |
消化器 | 悪心・嘔吐、腹痛・胃部不快感、食欲不振、便秘、口内炎、下痢 | 食欲亢進、腹部膨満感 |
肝臓 | AST上昇、ALT上昇、Al-P上昇 | 黄疸 |
過敏症 | 発疹、そう痒感 | |
その他 | 発熱、眼調節障害、ほてり、貧血 |
判定パラメータ | 参考パラメータ | |||
AUC0-24 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
チアプリド錠 25mg「日新」 | 2042.87±120.35 | 318.69±41.96 | 1.79±0.70 | 4.40±0.53 |
グラマリール錠25mg | 1992.32±202.67 | 305.75±53.81 | 2.00±0.78 | 5.37±1.97 |
判定パラメータ | 参考パラメータ | |||
AUC0-36 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
チアプリド錠 50mg「日新」 | 2059.77±211.43 | 376.14±57.56 | 1.9±0.4 | 3.8±1.1 |
グラマリール錠50mg | 2046.82±238.92 | 376.94±63.95 | 2.0±0.5 | 3.4±1.0 |
腎機能障害の程度 | t1/2(h) |
高 度 (Ccr 0~10、平均Ccr 2.9、n=5) やや高度 (Ccr 11~30、 Ccr 16.0、n=1) 中 等 度 (Ccr 31~60、平均Ccr 55.3、n=3) 軽 度 (Ccr 61~90、平均Ccr 69.6、n=4) | 21.6 8.63 7.54 4.24 |
Tmax(h) | Cmax(μg/mL) | t1/2(h) | AUC(μg/mL・h) |
1.8±0.2 | 0.876±0.127 | 5.75±0.59 | 5.89±0.85 |