1
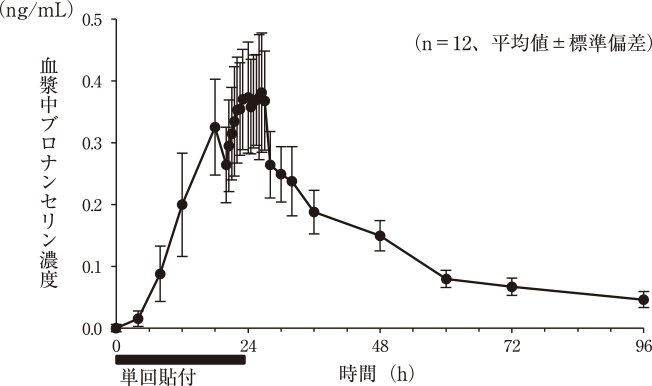
社内資料:健康成人における単回貼付試験(2019年6月18日承認、CTD2.7.6.2)
2
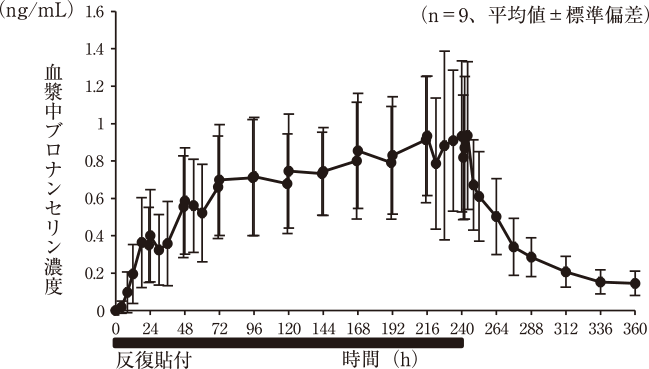
社内資料:健康成人における反復貼付試験(2019年6月18日承認、CTD2.7.6.3)
3
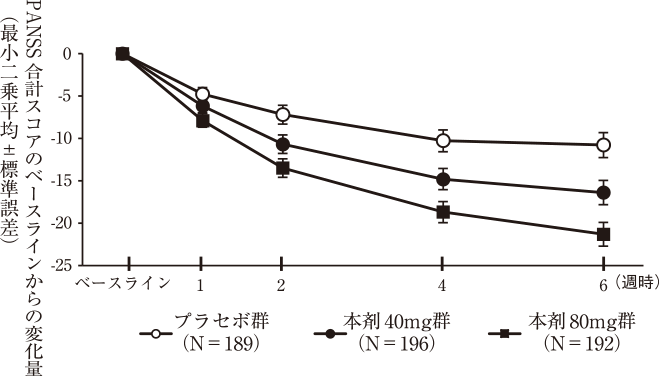
社内資料:国際共同第3相試験(2019年6月18日承認、CTD2.7.6.9)
4
社内資料:ヒト血清たん白結合の検討1(ヒト血清、ヒト血清アルブミンおよびα1-酸性糖蛋白を用いた検討)(ロナセン錠/散、2008年1月25日承認、CTD2.7.2.2)
5
社内資料:ヒト血清たん白結合の検討2(ブロナンセリンおよび代謝物を用いた検討)(ロナセン錠/散、2008年1月25日承認、CTD2.7.2.2)
6
社内資料:ヒト血清たん白結合の検討3(各種共存薬物との相互作用の検討)(ロナセン錠/散、2008年1月25日承認、CTD2.7.2.2)
7
社内資料:ヒトの血漿、尿および糞中の代謝物検索(ロナセン錠/散、2008年1月25日承認、CTD2.7.2.2)
8
社内資料:ヒト代謝CYPの同定(ロナセン錠/散、2008年1月25日承認、CTD2.7.2.2)
9
社内資料:14C標識体を用いたマスバランス試験(ロナセン錠/散、2008年1月25日承認、CTD2.7.2.2)
10
松本和也ほか:臨床精神薬理. 2008; 11:891-899
11
社内資料:ケトコナゾールとの薬物相互作用試験(ロナセン錠/散、2008年1月25日承認、CTD2.7.2.2)
12
社内資料:国内第3相長期投与試験(2019年6月18日承認、CTD2.7.6.10)
13
釆輝昭ほか:臨床精神薬理. 2007; 10:1263-1272
14
社内資料:ドパミンD2、D3及びセロトニン5-HT2A受容体に対する作動作用及び拮抗作用(2019年6月18日承認、CTD2.6.2.2)
15
社内資料:ムスカリンM3受容体への結合親和性(2019年6月18日承認、CTD2.6.2.2)
16
Noda Y., et al.:J. Pharmacol. Exp. Ther. 1993; 265:745-751
17
社内資料:メタンフェタミン誘発運動過多に対する抑制作用(ロナセン錠/散、2008年1月25日承認、CTD2.6.2.2)