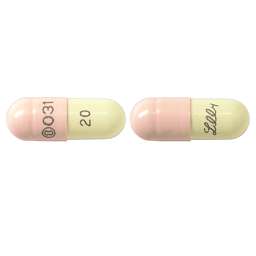
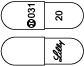
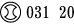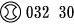1
高橋明比古ほか:臨床精神薬理. 2009;12:1411-1426
2
高橋明比古ほか:臨床精神薬理. 2009;12:1439-1454
3
高橋明比古ほか:臨床精神薬理. 2009;12:1455-1481
4
熊谷雄治:臨床精神薬理. 2009;12:1483-1497
5
高橋明比古ほか:臨床精神薬理. 2009;12:1427-1437
6
社内資料:臨床における薬物動態(2010/1/20承認、申請資料概要2.7.1.2,2.7.2.2,2.7.2.3)
7
社内資料:ラットにおける胎盤・胎児移行性(2010/1/20承認、申請資料概要2.6.4.4)
8
社内資料:臨床における薬物相互作用試験(2010/1/20承認、申請資料概要2.7.2.2,2.7.6.3)
9
社内資料:デュロキセチンの酸化的代謝に関与するCYP分子種の同定(2010/1/20承認、申請資料概要2.6.4.7)
10
村崎光邦,et al.:臨床精神薬理. 2009;12:1499-1515
11
樋口輝彦ほか:臨床精神薬理. 2009;12:1613-1634
12
樋口輝彦ほか:臨床精神薬理. 2009;12:1579-1593
13
Yasuda H,et al.:J Diabetes Investig.2011;2:132-139
14
Yasuda H,et al.:J Diabetes Investig.2016;7:100-108
15
社内資料:糖尿病性神経障害に伴う疼痛を対象とした国内第Ⅲ相継続投与試験(2012/2/22承認、申請資料概要2.7.6.2)
16
Murakami,M,et al.:Arthritis Res Ther.2015;17:224-236
17
社内資料:線維筋痛症を対象とした国内第Ⅲ相プラセボ対照試験(2015/5/26承認、申請資料概要2.7.6.1)
18
Murakami,M.et al.:Mod Rheumatol.2016; (doi:10.1080/14397595.2016.1245237)
19
Konno,S.,et al.:Spine.2016;41:1709-1717
20
社内資料:慢性腰痛症を対象とした国内第Ⅲ相プラセボ対照試験(2016/3/18承認、申請資料概要2.7.6.1)
21
社内資料:慢性腰痛症を対象とした国内第Ⅲ相継続長期投与試験(2016/3/18承認、申請資料概要2.7.6.5)
22
社内資料:変形性関節症を対象とした国内第Ⅲ相プラセボ対照試験(2016/12/19承認、申請資料概要2.7.6.1)
23
社内資料:変形性関節症を対象とした国内第Ⅲ相継続長期投与試験(2016/12/19承認、申請資料概要2.7.6.5)
24
社内資料:in vitro及びex vivoにおけるモノアミン取り込み阻害作用(2010/1/20承認、申請資料概要2.6.2.2)
25
社内資料:ラット及びマウスにおけるモノアミン取り込み阻害並びにin vitroにおけるモノアミン酸化酵素阻害作用(2010/1/20承認、申請資料概要2.6.2.2)
26
社内資料:脳内の細胞外モノアミン濃度増加作用(2010/1/20承認、申請資料概要2.6.2.2,2.6.2.6)
27
社内資料:脳内各種神経伝達物質受容体に対する特異性試験(2010/1/20承認、申請資料概要2.6.2.2)
28
社内資料:ラットにおける抗うつ作用(2010/1/20承認、申請資料概要2.6.2.2)
29
社内資料:神経障害性疼痛動物モデルにおける効果(2012/2/22承認、申請資料概要2.6.2.2)
30
社内資料:その他疼痛動物モデルにおける効果(2012/2/22承認、申請資料概要2.6.2.2)