1
Kristensen,J.H.,et al.:Br.J.Clin.Pharmacol.2007;63(3):322-327
2
Ruigt,G.S.F.,et al.:Eur.J.Clin.Pharmacol.1990;38(6):551-554
3
薬理試験(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要2.6.2.2)
4
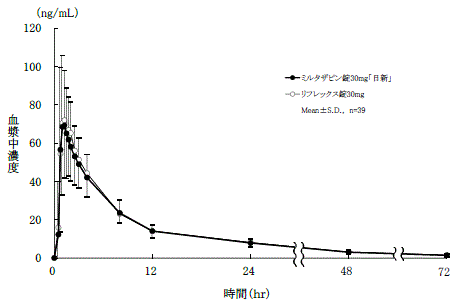
社内資料:生物学的同等性試験(錠30mg)
5
Dahl,M.-L.,et al.:Clin.Drug Invest.1997;13(1):37-46
6
マスバランス試験(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要2.7.2.2)
7
Bengtsson,F.,et al.:Hum.Psychopharmacol.Clin.Exp.1998;13:357-365
8
肝機能低下の影響(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要2.7.2.2)
9
Timmer,C.J.,et al.:Human psychopharmacology.1996;11:497-509
10
薬物相互作用(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要2.7.2.2)
11
Spaans,E.,et al.:Eur.J.Clin.Pharmacol.2002;58:423-429
12
Sitsen,J.M.A.,et al.:J.Psychopharmacol.2000;14(2):172-176
13
社内資料:生物学的同等性試験(錠15mg)
14
Brunton,L.L.et al.:グッドマン・ギルマン薬理書 第12版上巻(髙折修二ほか監訳).東京:廣川書店;2013.p506