1
遺伝子および遺伝子重複に基づいたCYP2D6分類(ストラテラカプセル:2012年8月24日承認、申請資料概要2.7.2.1)
2
日本人健康成人を対象としたアトモキセチン単回投与試験(LYAN 試験)(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.2.2)
3
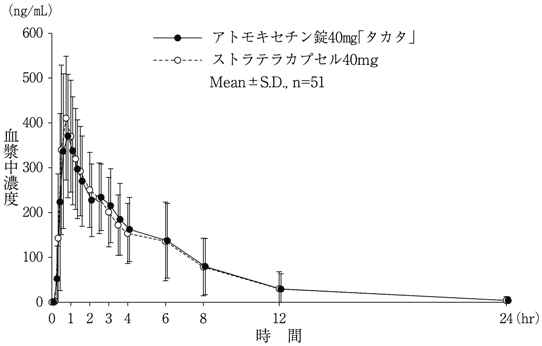
社内資料:生物学的同等性試験(アトモキセチン錠40mg「タカタ」)
4
代謝(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.2.3)
5
外国人健康成人における臨床薬理試験の併合解析から得られた薬物動態パラメータ(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.2.5)
6
CYP2D6 分類の変更に伴う LYAN 試験の再解析(ストラテラカプセル:2012年8月24日承認、申請資料概要2.7.2.2)
7
末期腎不全を有する成人にアトモキセチンを単回投与したときの薬物動態の検討(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.2.2)
8
肝硬変を有する成人におけるアトモキセチン単回投与後の薬物動態についての検討(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.2.2)
9
アトモキセチン併用時におけるサルブタモール吸入投与後の血行力学パラメータの変化についての検討(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.6.2)
10
アトモキセチン反復投与時におけるサルブタモール単回静脈内投与後の血行力学パラメータの変化についての検討(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.2.2)
11
健康成人を対象としたアトモキセチン及びパロキセチン併用時における安全性及び薬物動態学的相互作用の検討(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.2.2)
12
健康成人を対象としたアトモキセチン及びフルオキセチン併用時における安全性及び薬物動態学的相互作用の検討(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.2.2)
13
社内資料:生物学的同等性試験及び溶出性試験(アトモキセチン錠5mg「タカタ」)
14
社内資料:生物学的同等性試験及び溶出性試験(アトモキセチン錠10mg「タカタ」)
15
社内資料:生物学的同等性試験及び溶出性試験(アトモキセチン錠25mg「タカタ」)
16
Takahashi M, et al.: J. Child Adolesc. Psychopharmacol. 2009; 19(4): 341-350
17
小児AD/HD患者に対する国内プラセボ対照二重盲検比較試験(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.6.3)
18
小児AD/HD患者に対する国内長期継続投与試験 中間報告(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.6.3)
19
Michelson D, et al.: Pediatrics. 2001; 108(5): e83
20
外国プラセボ対照二重盲検比較試験(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.3.2)
21
用量設定試験:LYAC 試験(ストラテラカプセル:2009年4月22日承認、申請資料概要2.7.4.2)
22
緒言(ストラテラカプセル:2009年4月22日承認、申請資料概要2.6.1)