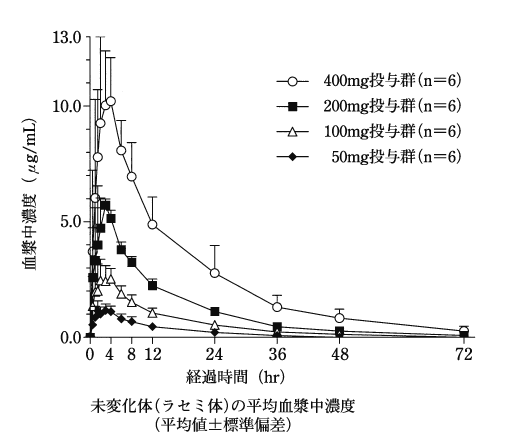
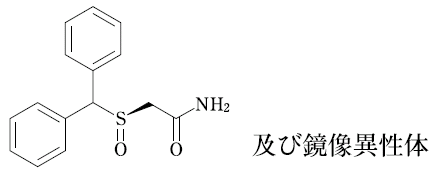
1
厚生労働省:重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群
2
社内資料:国内第Ⅰ相単回投与時の薬物動態に関する資料(2007年1月26日承認、CTD2.7.6.9)
3
社内資料:国内第Ⅰ相反復投与時の薬物動態に関する資料(2007年1月26日承認、CTD2.7.6.10)
4
社内資料:国内第Ⅰ相食事による影響の検討に関する資料(2007年1月26日承認、CTD2.7.6.1)
5
社内資料:反復経口投与時の薬物動態に関する資料(2007年1月26日承認、CTD2.7.6.7)
6
社内資料:ヒトにおける代謝及び排泄の検討に関する資料(2007年1月26日承認、CTD2.7.6.8)
7
Robertson, P. et al.:Drug Metab Dispos.2000; 28: 664-671
8
社内資料:腎機能障害患者における薬物動態に関する資料(2007年1月26日承認、CTD2.7.6.15)
9
Moachon, G. et al.:Can J Physiol Pharmacol.1994; 72: Abst P12.2.36
10
Wong, YN. et al.:J Clin Pharmacol.1998; 38: 276-282
11
社内資料:クロミプラミン併用時の薬物動態に関する資料(2007年1月26日承認、CTD2.7.6.21)
12
Groezinger, M. et al.:Clin Neuropharmacol.1998; 21: 127-129
13
Robertson, P. et al.:Clin Pharmacol Ther.2002; 71: 46-56
14
Le Cacheux, P. et al.:Presse Med.1997; 26: 466
15
井上雄一 他:睡眠医療.2007; 1: 85-97
16
井上雄一 他:臨床精神薬理.2011; 14: 479-491
17
社内資料:特発性過眠症を対象とした国内第Ⅲ相D.B.試験(2020年2月21日承認、CTD 2.7.6.1)
18
社内資料:特発性過眠症を対象とした国内第Ⅲ相長期投与試験(2020年2月21日承認、CTD 2.7.6.4)
19
Inoue, Y. et al.:J Clin Sleep Med.2013; 9: 751-757
20
社内資料:閉塞性睡眠時無呼吸症候群を対象とした国内第Ⅲ相D.B.試験(2011年11月25日承認、CTD 2.7.6.1)
21
社内資料:閉塞性睡眠時無呼吸症候群を対象とした国内第Ⅲ相長期投与試験(2011年11月25日承認、CTD 2.7.6.9)
22
Lin, JS. et al.:Proc Natl Acad Sci U S A.1996; 93: 14128-14133
23
Tanganelli, S. et al.:Naunyn Schmiedebergs Arch Pharmacol.1992; 345: 461-465
24
Ferraro, L. et al.:Neurosci Lett.1996; 220: 5-8
25
Ferraro, L. et al.:Eur J Pharmacol.1996; 306: 33-39
26
Ishizuka, T. et al.:Neurosci Lett.2003; 339: 143-146
27
Ishizuka, T. et al.:Eur J Pharmacol.2008; 578: 209-215
28
社内資料:神経伝達物質受容体等に対する親和性の検討に関する資料(2007年1月26日承認、CTD2.6.2.2.2)
29
社内資料:トランスポーターに対する親和性の検討に関する資料(2007年1月26日承認、CTD2.6.2.2.2)
30
Shelton, J. et al.:Sleep.1995; 18: 817-826
31
Edgar, DM. et al.:J Pharmacol Exp Ther.1997; 283: 757-769
32
Panckeri, KA. et al.:Sleep.1996; 19: 626-631