1
Schlotterbeck, P. et al.:Int J Neuropsychopharmacol. 2007;10(3):433.
2
反復投与(エビリファイ:2006年1月23日承認、CTD2.7.6.3)
3
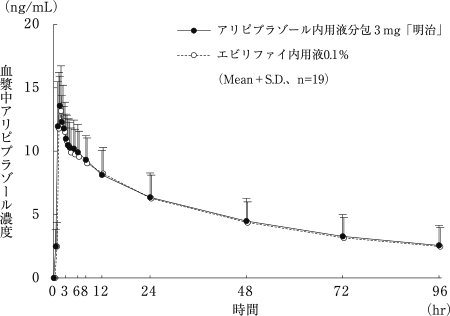
社内資料:アリピプラゾール内用液分包3mg「明治」の生物学的同等性試験に関する資料
4
食事の影響(エビリファイ:2006年1月23日承認、CTD2.7.6.1)
5
絶対的バイオアベイラビリティ(エビリファイ:2006年1月23日承認、CTD2.7.6.1)
6
分布容積(エビリファイ:2006年1月23日承認、CTD2.7.6.3)
7
分布容積(エビリファイ:2006年1月23日承認、CTD2.7.2.3)
8
血清蛋白結合率(エビリファイ:2006年1月23日承認、CTD2.7.2.3)
9
代謝(エビリファイ:2006年1月23日承認、CTD2.7.1.2)
10
代謝(エビリファイ:2006年1月23日承認、CTD2.7.2.3)
11
代謝(エビリファイ:2006年1月23日承認、CTD2.7.6.3)
12
排泄(エビリファイ:2006年1月23日承認、CTD2.7.6.3)
13
腎機能障害患者(エビリファイ:2006年1月23日承認、CTD2.7.6.3)
14
肝機能障害患者(エビリファイ:2006年1月23日承認、CTD2.7.6.3)
15
高齢者(エビリファイ:2006年1月23日承認、CTD2.7.6.3)
16
性別・喫煙(エビリファイ:2006年1月23日承認、CTD2.7.6.3)
17
性別・喫煙(エビリファイ:2006年1月23日承認、CTD2.5.3.2)
18
薬物相互作用(エビリファイ:2006年1月23日承認、CTD2.7.6.3)
19
薬物相互作用(エビリファイ:2013年6月14日承認、CTD2.7.6.2)
20
国内第Ⅲ相試験(エビリファイ:2006年1月23日承認、CTD2.7.6.5)
21
急性期試験(エビリファイ:2006年1月23日承認、CTD2.7.6.5)
22
再発予防試験(エビリファイ:2006年1月23日承認、CTD2.7.6.5)
23
第Ⅲ相国際共同試験(短期試験)(エビリファイ:2012年1月18日承認、審査報告書)
24
第Ⅲ相国際共同試験(短期試験)(エビリファイ:2012年1月18日承認、CTD2.7.6.3)
25
作用機序(エビリファイ:2006年1月23日承認、CTD2.6.1.2)
26
受容体親和性(エビリファイ:2006年1月23日承認、CTD2.6.2.2)
27
ドパミンD2受容体部分アゴニスト作用(エビリファイ:2006年1月23日承認、CTD2.6.2.2)
28
ドパミンD2受容体部分アゴニスト作用(エビリファイ:2006年1月23日承認、CTD2.6.2.6)
29
Tadori, Y. et al.:Eur J Pharmacol.2008;597(1-3):27-33.
30
セロトニン5-HT1A受容体部分アゴニスト作用(エビリファイ:2006年1月23日承認、CTD2.6.2.2)
31
セロトニン5-HT2A受容体アンタゴニスト作用(エビリファイ:2006年1月23日承認、CTD2.6.2.2)
32
統合失調症諸症状に関連する動物モデルでの改善作用(エビリファイ:2006年1月23日承認、CTD2.6.2.2)
33
カタレプシー惹起作用(エビリファイ:2006年1月23日承認、CTD2.6.2.2)
34
血中プロラクチン濃度を調節する下垂体前葉ドパミンD2受容体に対する作用(エビリファイ:2006年1月23日承認、CTD2.6.2.2)