1
Schlotterbeck,P.et al.:Int J Neuropsychopharmacol.2007;10(3):433.
2
単回経口投与試験(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.1.2、2.7.6.1)
3
反復経口投与試験(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.3)
4
代謝(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.2.3)
5
松木俊二他:臨床医薬, 33(4):319, 2017.
6
食事による影響の検討(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.1)
7
絶対的バイオアベイラビリティ(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.1)
8
静脈内投与時の血漿中動態(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.2.3)
9
蛋白結合率(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.2.3)
10
排泄(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.3)
11
腎障害患者における薬物動態(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.3)
12
肝障害患者における薬物動態(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.3)
13
年齢、性別による影響(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.3)
14
母集団薬物動態及び薬力学解析(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.3)
15
キニジンとの相互作用(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.3)
16
Azuma,J.et al.:Eur J Clin Pharmacol.2012;68(1):29-37.
17
Kubo,M.et al.:Drug Metab Pharmacokinet.2005;20(1):55-64.
18
ケトコナゾールとの相互作用(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.3)
19
カルバマゼピンとの相互作用(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.3)
20
活性炭併用投与時の薬物動態(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.3)
21
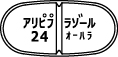
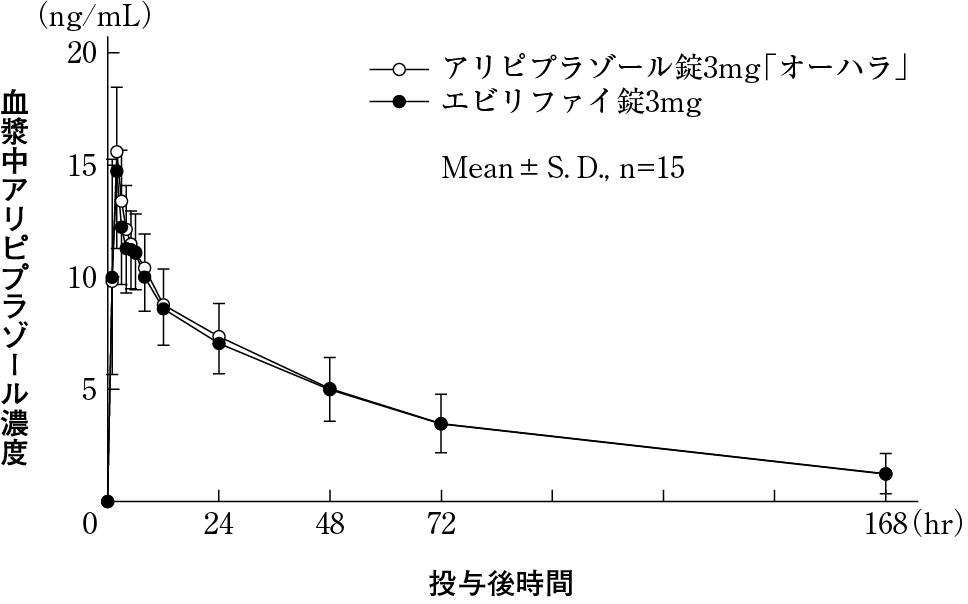
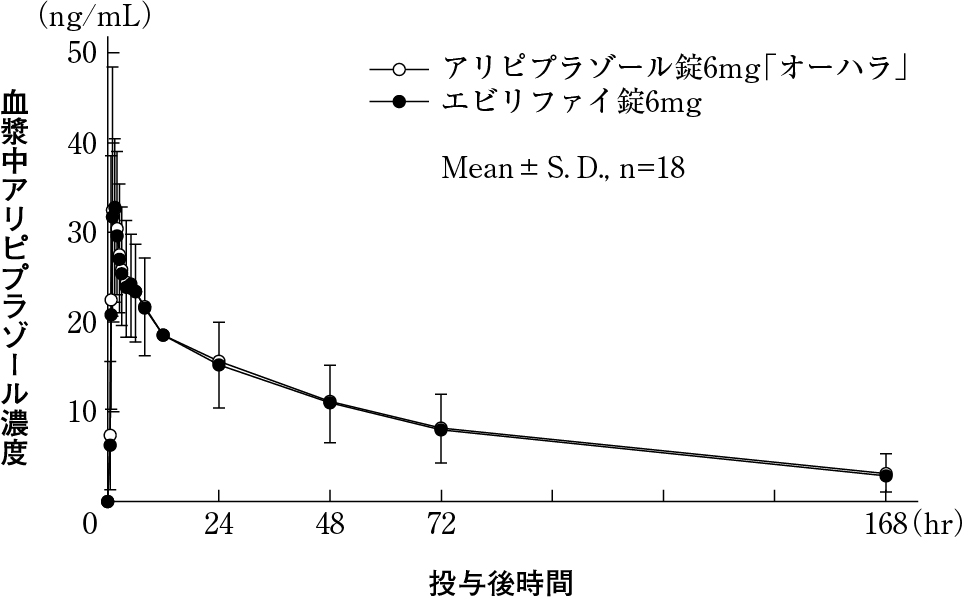
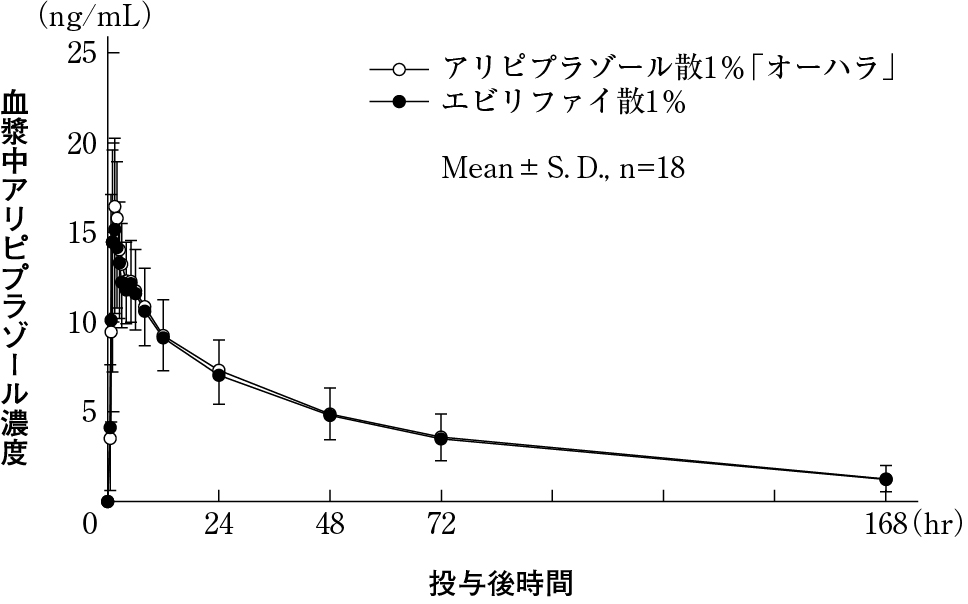
大原薬品工業株式会社 社内資料:生物学的同等性試験
22
統合失調症を対象とした臨床試験(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.7.6.5)
23
用法・用量(エビリファイ錠/散:2006年1月23日承認、審査報告書)
24
アリピプラゾールの薬理作用(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.6.1.2)
25
Burris,K.D.et al.:J Pharmacol Exp Ther.2002;302(1):381-389.
26
Jordan,S.et al.:Eur J Pharmacol.2002;441(3):137-140.
27
各種受容体に対する親和性(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.6.2.2)
28
Inoue,T.et al.:J Pharmacol Exp Ther.1996;277(1):137-143.
29
Kikuchi,T.et al.:J Pharmacol Exp Ther.1995;274(1):329-336.
30
Tadori,Y.et al.:Eur J Pharmacol.2008;597(1-3):27-33.
31
ラットにおけるセロトニン神経活動に対する作用(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.6.2.2)
32
Hirose,T.et al.:J Psychopharmacol.2004;18(3):375-383.
33
ラットセロトニン5-HT2A受容体に対する薬理学的検討(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.6.2.2)
34
統合失調症及び不安の動物モデル(エビリファイ錠/散:2006年1月23日承認、申請資料概要2.6.2.2)