作成又は改訂年月
**
2019年3月改訂
(第12版)
*
2018年3月改訂
日本標準商品分類番号
薬効分類名
承認等
販売名
クエチアピン錠12.5mg「MEEK」
販売名コード
承認・許可番号
22600AMX01134000
QUETIAPINE Tablets 12.5mg「MEEK」
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
気密容器、室温保存
使用期限:
外箱等に表示
基準名
規制区分
劇薬
処方箋医薬品
注意―医師等の処方箋により使用すること
組成
成分・含量
1錠中、日局クエチアピンフマル酸塩14.39mg(クエチアピンとして12.5mg)含有
添加物
乳糖水和物
結晶セルロース
リン酸水素カルシウム水和物
ポビドン
デンプングリコール酸ナトリウム
ステアリン酸マグネシウム
ヒプロメロース
酸化チタン
マクロゴール400
性状
| 性状 | 白色のフィルムコート錠 |
|---|
| 大きさ | 直径:約5.1mm
厚さ:約1.8mm
重量:約42mg |
|---|
| 外形 |  |
|---|
| 識別コード | MK66 |
|---|
販売名
クエチアピン錠25mg「MEEK」
販売名コード
承認・許可番号
22400AMX01076000
QUETIAPINE Tablets 25mg「MEEK」
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
気密容器、室温保存
使用期限:
外箱等に表示
基準名
規制区分
劇薬
処方箋医薬品
注意―医師等の処方箋により使用すること
組成
成分・含量
1錠中、日局クエチアピンフマル酸塩28.78mg(クエチアピンとして 25mg)含有
添加物
乳糖水和物
結晶セルロース
リン酸水素カルシウム水和物
ポビドン
デンプングリコール酸ナトリウム
ステアリン酸マグネシウム
ヒプロメロース
酸化チタン
マクロゴール400
黄色三二酸化鉄
三二酸化鉄
性状
| 性状 | うすい黄みの赤色のフィルムコート錠 |
|---|
| 大きさ | 直径:約6.1mm
厚さ:約2.5mm
重量:約73mg |
|---|
| 外形 |  |
|---|
| 識別コード | MK59 |
|---|
販売名
クエチアピン錠50mg「MEEK」
販売名コード
承認・許可番号
22600AMX01135000
QUETIAPINE Tablets 50mg「MEEK」
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
気密容器、室温保存
使用期限:
外箱等に表示
基準名
規制区分
劇薬
処方箋医薬品
注意―医師等の処方箋により使用すること
組成
成分・含量
1錠中、日局クエチアピンフマル酸塩57.56mg(クエチアピンとして50mg)含有
添加物
乳糖水和物
結晶セルロース
リン酸水素カルシウム水和物
ポビドン
デンプングリコール酸ナトリウム
ステアリン酸マグネシウム
ヒプロメロース
酸化チタン
マクロゴール400
性状
| 性状 | 白色の割線入りのフィルムコート錠 |
|---|
| 大きさ | 直径:約7.1mm
厚さ:約3.5mm
重量:約145mg |
|---|
| 外形 |  |
|---|
| 識別コード | MK67 |
|---|
販売名
クエチアピン錠100mg「MEEK」
販売名コード
承認・許可番号
22400AMX01077000
QUETIAPINE Tablets 100mg「MEEK」
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
気密容器、室温保存
使用期限:
外箱等に表示
基準名
規制区分
劇薬
処方箋医薬品
注意―医師等の処方箋により使用すること
組成
成分・含量
1錠中、日局クエチアピンフマル酸塩115.13mg(クエチアピンとして100mg)含有
添加物
乳糖水和物
結晶セルロース
リン酸水素カルシウム水和物
ポビドン
デンプングリコール酸ナトリウム
ステアリン酸マグネシウム
ヒプロメロース
酸化チタン
マクロゴール400
黄色三二酸化鉄
性状
| 性状 | うすい黄色のフィルムコート錠 |
|---|
| 大きさ | 直径:約8.6mm
厚さ:約4.6mm
重量:257mg |
|---|
| 外形 |  |
|---|
| 識別コード | MK60 |
|---|
販売名
クエチアピン錠200mg「MEEK」
販売名コード
承認・許可番号
22400AMX01078000
QUETIAPINE Tablets 200mg「MEEK」
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
気密容器、室温保存
使用期限:
外箱等に表示
基準名
規制区分
劇薬
処方箋医薬品
注意―医師等の処方箋により使用すること
組成
成分・含量
1錠中、日局クエチアピンフマル酸塩230.26mg (クエチアピンとして200mg)含有
添加物
乳糖水和物
結晶セルロース
リン酸水素カルシウム水和物
ポビドン
デンプングリコール酸ナトリウム
ステアリン酸マグネシウム
ヒプロメロース
酸化チタン
マクロゴール400
性状
| 性状 | 白色のフィルムコート錠 |
|---|
| 大きさ | 直径:約11.1mm
厚さ:約5.5mm
重量:514mg |
|---|
| 外形 |  |
|---|
| 識別コード | MK61 |
|---|
販売名
クエチアピン細粒50%「MEEK」
販売名コード
承認・許可番号
22700AMX00454000
QUETIAPINE Fine granules 50%「MEEK」
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
気密容器、室温保存
使用期限:
外箱等に表示
基準名
規制区分
劇薬
処方箋医薬品
注意―医師等の処方箋により使用すること
組成
成分・含量
1g中、日局クエチアピンフマル酸塩575.65mg(クエチアピンとして500mg)含有
添加物
D-マンニトール
部分アルファー化デンプン
ヒドロキシプロピルセルロース
軽質無水ケイ酸
スクラロース
タウマチン
性状
警告
著しい血糖値の上昇から、糖尿病性ケトアシドーシス、糖尿病性昏睡等の重大な副作用が発現し、死亡に至る場合があるので、本剤投与中は、血糖値の測定等の観察を十分に行うこと。
投与にあたっては、あらかじめ上記副作用が発現する場合があることを、患者及びその家族に十分に説明し、口渇、多飲、多尿、頻尿等の異常に注意し、このような症状があらわれた場合には、直ちに投与を中断し、医師の診察を受けるよう、指導すること。(「重要な基本的注意」の項参照)
*禁忌
昏睡状態の患者[昏睡状態を悪化させるおそれがある。]
バルビツール酸誘導体等の中枢神経抑制剤の強い影響下にある患者[中枢神経抑制作用が増強される。]
*アドレナリンを投与中の患者(アドレナリンをアナフィラキシーの救急治療に使用する場合を除く)(「相互作用」の項参照)
本剤の成分に対し過敏症の既往歴のある患者
糖尿病の患者、糖尿病の既往歴のある患者
効能又は効果/用法及び用量
効能又は効果
用法及び用量
通常、成人にはクエチアピンとして1回25mg、1日2又は3回より投与を開始し、患者の状態に応じて徐々に増量する。通常、1日投与量は150〜600mgとし、2又は3回に分けて経口投与する。
なお、投与量は年齢・症状により適宜増減する。ただし、1日量として750mgを超えないこと。
**,*使用上の注意
慎重投与
肝機能障害のある患者[本剤は主に肝臓により代謝されるため、クリアランスが減少し、血漿中濃度が上昇することがある。少量(例えば1回25mg1日1回)から投与を開始し、1日増量幅を25〜50mgにするなど患者の状態を観察しながら慎重に投与すること。]
心・血管疾患、脳血管障害、低血圧又はそれらの疑いのある患者[投与初期に一過性の血圧降下があらわれることがある。]
てんかん等の痙攣性疾患、又はこれらの既往歴のある患者[痙攣閾値を低下させるおそれがある。]
不整脈又はその既往歴のある患者、先天性QT延長症候群の患者、又はQT延長を起こすことが知られている薬剤を投与中の患者[本剤の投与によりQT間隔が延長する可能性がある。]
自殺企図の既往及び自殺念慮を有する患者[症状を悪化させるおそれがある。]
高齢者(「高齢者への投与」の項参照)
糖尿病の家族歴、高血糖あるいは肥満等の糖尿病の危険因子を有する患者(「重要な基本的注意」の項参照)
重要な基本的注意
本剤の投与により、著しい血糖値の上昇から、糖尿病性ケトアシドーシス、糖尿病性昏睡等の致命的な経過をたどることがあるので、本剤投与中は、血糖値の測定や口渇、多飲、多尿、頻尿等の観察を十分に行うこと。特に、高血糖、肥満等の糖尿病の危険因子を有する患者では、血糖値が上昇し、代謝状態を急激に悪化させるおそれがある。
本剤の投与により、低血糖があらわれることがあるので、本剤投与中は、脱力感、倦怠感、冷汗、振戦、傾眠、意識障害等の低血糖症状に注意するとともに、血糖値の測定等の観察を十分に行うこと。
本剤の投与に際し、あらかじめ上記1.及び2.の副作用が発現する場合があることを、患者及びその家族に十分に説明し、高血糖症状(口渇、多飲、多尿、頻尿等)、低血糖症状(脱力感、倦怠感、冷汗、振戦、傾眠、意識障害等)に注意し、このような症状があらわれた場合には、直ちに投与を中断し、医師の診察を受けるよう、指導すること。
本剤の投与により体重増加を来すことがあるので、肥満に注意し、肥満の徴候があらわれた場合は、食事療法、運動療法等の適切な処置を行うこと。
本剤は、特に治療開始初期に起立性低血圧を起こすことがあるので、立ちくらみ、めまい等の低血圧症状があらわれた場合には減量等、適切な処置を行うこと。
本剤は主として中枢神経系に作用するため、眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないように注意すること。
前治療薬からの切り替えの際、精神症状が悪化する可能性があるので観察を十分行いながら前治療薬の用量を減らしつつ、本薬を徐々に増量することが望ましい。また、症状の悪化が認められた場合には、他の治療法に切り替えるなど適切な処置を行うこと。
投与量の急激な減少ないし投与の中止により、不眠、悪心、頭痛、下痢、嘔吐等の離脱症状があらわれることがある。投与を中止する場合には、徐々に減量するなど慎重に行うこと。
抗精神病薬において、肺塞栓症、静脈血栓症等の血栓塞栓症が報告されているので、不動状態、長期臥床、肥満、脱水状態等の危険因子を有する患者に投与する場合には注意すること。
相互作用
相互作用の概略
本剤は複数の経路で広範に代謝される。本剤の代謝に関与する主なP450酵素はCYP3A4である。
併用禁忌
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
*アドレナリン
(アナフィラキシーの救急治療に使用する場合を除く)
(ボスミン) | アドレナリンの作用を逆転させ、重篤な血圧降下を起こすことがある。 | アドレナリンはアドレナリン作動性α、β-受容体の刺激剤であり、本剤のα-受容体遮断作用により、β-受容体の刺激作用が優位となり、血圧降下作用が増強される。 |
|---|
併用注意
注)これらの薬剤を投与中止する場合には、本剤の減量を要することがある。
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
中枢神経抑制剤
アルコール | 中枢神経抑制作用が増強することがあるので、個々の患者の症状及び忍容性に注意し、慎重に投与すること。 | 薬力学的相互作用を起こすことがある。 |
|---|
| CYP3A4誘導作用を有する薬剤注):フェニトイン、カルバマゼピン、バルビツール酸誘導体、リファンピシン等 | 本剤の作用が減弱することがある。 | 本剤の主要代謝酵素であるCYP3A4の誘導により、本剤のクリアランスが増加することがある。外国人におけるフェニトイン併用投与例において、クエチアピン製剤の経口クリアランスが約5倍に増加し、Cmax及びAUCはそれぞれ66%及び80%低下した。 |
|---|
| 強いCYP3A4阻害作用を有する薬剤:イトラコナゾール等 | 本剤の作用を増強するおそれがあるので、個々の患者の症状及び忍容性に注意し、本剤を減量するなどして慎重に投与すること。
併用により本剤の血漿中濃度が高値となり、QT間隔が延長するおそれがある。 | 本剤の主要代謝酵素であるCYP3A4を強く阻害するため、血漿中濃度が上昇する可能性がある。外国人に強いCYP3A4阻害剤であるケトコナゾール(経口剤:国内未発売)を併用投与したとき、クエチアピンのCmax及びAUCはそれぞれ単独投与の3.35倍及び6.22倍であった。 |
|---|
| CYP3A4阻害作用を有する薬剤:エリスロマイシン等 | 本剤の作用を増強するおそれがあるので、個々の患者の症状及び忍容性に注意し、慎重に投与すること。 | 本剤の主要代謝酵素であるCYP3A4を阻害するため、血漿中濃度が上昇する可能性がある。 |
|---|
副作用
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
高血糖、糖尿病性ケトアシドーシス、糖尿病性昏睡(頻度不明):高血糖があらわれ、糖尿病性ケトアシドーシス、糖尿病性昏睡から死亡に至るなどの致命的な経過をたどることがあるので、血糖値の測定や、口渇、多飲、多尿、頻尿等の観察を十分に行い、異常が認められた場合には、投与を中止し、インスリン製剤の投与を行うなど、適切な処置を行うこと。
低血糖(頻度不明):低血糖があらわれることがあるので、脱力感、倦怠感、冷汗、振戦、傾眠、意識障害等の低血糖症状が認められた場合には、投与を中止し適切な処置を行うこと。
悪性症候群(Syndrome malin)(頻度不明):悪性症候群があらわれることがあるので、無動緘黙、強度の筋強剛、嚥下困難、頻脈、血圧の変動、発汗等が発現し、それにひきつづき発熱がみられる場合は、投与を中止し、体冷却、水分補給等の全身管理とともに適切な処置を行うこと。本症発症時には、白血球の増加やCK(CPK)の上昇がみられることが多く、また、ミオグロビン尿を伴う腎機能低下がみられることがある。
なお、高熱が持続し、意識障害、呼吸困難、循環虚脱、脱水症状、急性腎障害へと移行し、死亡した例が報告されている。
横紋筋融解症(頻度不明):横紋筋融解症があらわれることがあるので、筋肉痛、脱力感、CK(CPK)上昇、血中及び尿中ミオグロビン上昇等が認められた場合には投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎障害の発症に注意すること。
痙攣(頻度不明):痙攣があらわれることがある。このような症状があらわれた場合には投与を中止するなど適切な処置を行うこと。
無顆粒球症、白血球減少(頻度不明):無顆粒球症、白血球減少があらわれることがあるので、血液検査を行うなど、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
肝機能障害、黄疸(頻度不明):AST(GOT)、ALT(GPT)、γ-GTP、Al-Pの上昇等を伴う肝機能障害、黄疸があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
麻痺性イレウス(頻度不明):腸管麻痺(食欲不振、悪心・嘔吐、著しい便秘、腹部の膨満あるいは弛緩及び腸内容物のうっ滞等の症状)を来し、麻痺性イレウスに移行することがあるので、腸管麻痺があらわれた場合には、投与を中止するなど適切な処置を行うこと。
遅発性ジスキネジア(頻度不明):口周部等の不随意運動があらわれ、投与中止後も持続することがある。
肺塞栓症、深部静脈血栓症(頻度不明):抗精神病薬において、肺塞栓症、静脈血栓症等の血栓塞栓症が報告されているので、観察を十分に行い、息切れ、胸痛、四肢の疼痛、浮腫等が認められた場合には、投与を中止するなど適切な処置を行うこと。
**中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑(頻度不明):中毒性表皮壊死融解症、皮膚粘膜眼症候群、多形紅斑があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
その他の副作用
| | 頻度不明 |
| 精神神経系 | 不眠、易刺激性、傾眠、不安、頭痛、めまい、焦躁感、鎮静、幻覚の顕在化、健忘、攻撃的反応、意識レベルの低下、昏迷、神経症、妄想の顕在化、リビドー亢進、感情不安定、激越、錯乱、思考異常、自殺企図、人格障害、躁病反応、多幸症、舞踏病様アテトーシス、片頭痛、悪夢、うつ病、独語、衝動行為、自動症、せん妄、敵意、統合失調性反応、協調不能、レストレスレッグス症候群、軽躁、注意力障害、過眠症、自殺念慮、自傷行動 |
| 錐体外路症状 | アカシジア、振戦、構音障害、筋強剛、流涎過多、運動緩慢、歩行障害、ジスキネジア、嚥下障害、ジストニア、眼球回転発作、パーキンソン症候群、構語障害、錐体外路障害 |
| 血 液 | 顆粒球減少、好酸球増加症、貧血、血小板減少、白血球数増加 |
| 循環器系 | 頻脈、起立性低血圧、心悸亢進、心電図異常、低血圧、高血圧、徐脈、不整脈、失神、血管拡張、動悸、心電図QT延長 |
| 肝 臓 | AST(GOT)上昇、ALT(GPT)上昇、LDH上昇、Al-P上昇、γ-GTP上昇、ビリルビン血症、肝機能検査異常 |
| 呼吸器系 | 去痰困難、鼻炎、咳増加、鼻閉 |
| 消化器系 | 便秘、食欲減退、悪心、食欲亢進、嘔吐、腹痛、下痢、消化不良、胃炎、胃不快感、鼓腸放屁、消化管障害、吐血、直腸障害、過食、腹部膨満、胃食道逆流性疾患、膵炎 |
| 眼 | 瞳孔反射障害、弱視、結膜炎 |
| 代謝・内分泌 | 高プロラクチン血症、T4減少、高コレステロール血症、T3減少、月経異常、甲状腺疾患、高脂血症、高カリウム血症、肥満症、痛風、低ナトリウム血症、水中毒、多飲症、TSH減少、TSH上昇、高トリグリセリド血症、高尿酸血症、尿糖陽性、FT4減少、乳汁漏出症 |
| 過敏症 | 発疹、血管浮腫、そう痒、湿疹 |
| 泌尿器系 | 排尿障害、排尿困難、尿失禁、尿閉、BUN上昇、持続勃起、射精異常、インポテンス、頻尿、膀胱炎、尿蛋白陽性 |
| その他 | 倦怠感、無力症、CK(CPK)上昇、口内乾燥、体重増加、意欲低下、多汗、発熱、体重減少、胸痛、筋肉痛、舌麻痺、しびれ感、背部痛、浮腫、末梢性浮腫、ほてり、歯痛、関節痛、顔面浮腫、頸部硬直、腫瘤、過量投与、骨盤痛、歯牙障害、関節症、滑液包炎、筋無力症、痙縮、悪化反応、偶発外傷、耳の障害、味覚倒錯、ざ瘡、脱毛症、薬剤離脱症候群(不眠、悪心、頭痛、下痢、嘔吐)、口渇、回転性めまい、悪寒、靭帯捻挫 |
高齢者への投与
高齢者では少量(例えば1回25mg1日1回)から投与を開始し、1日増量幅を25〜50mgにするなど患者の状態を観察しながら慎重に投与すること。[高齢者では非高齢者に比べてクエチアピンの経口クリアランスが30〜50%低く、AUCは約1.5倍であり、高い血漿中濃度が持続する傾向が認められている。また、海外臨床試験において非高齢者と比較し、起立性低血圧の発現頻度が増加する傾向が認められている。]
妊婦、産婦、授乳婦等への投与
妊婦等:妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[妊娠中の投与に関する安全性は確立していない。動物実験(ラット及びウサギ)で胎児への移行が報告されている。また、妊娠後期に抗精神病薬が投与されている場合、新生児に哺乳障害、傾眠、呼吸障害、振戦、筋緊張低下、易刺激性等の離脱症状や錐体外路症状があらわれたとの報告がある。]
授乳婦:授乳中の婦人に投与する場合には、授乳を中止させること。[母乳中へ移行することが報告されている。]
小児等への投与
小児等に対する安全性は確立していない。(使用経験がない。)
過量投与
症状:主な症状は傾眠、鎮静、頻脈、低血圧等である。まれに昏睡、死亡に至る症例が報告されている。
処置:本剤に特異的な解毒剤はないため維持療法を行うこと。早期の胃洗浄は有効である。呼吸抑制があらわれた場合には気道の確保、人工呼吸等の適切な処置を行うこと。低血圧があらわれた場合には輸液、交感神経作動薬の投与等の適切な処置を行うこと。ただし、アドレナリン、ドパミンは、本剤のα-受容体遮断作用により低血圧を悪化させる可能性があるので投与しないこと。
適用上の注意
薬剤交付時:PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。[PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。]
その他の注意
クエチアピン製剤による治療中、原因不明の突然死が報告されている。
国内臨床試験において、クエチアピン製剤と因果関係が不明の心筋梗塞、出血性胃潰瘍が報告されている。また、外国長期投与試験において、急性腎障害が報告されている。
外国で実施された認知症に関連した精神病症状(承認外効能・効果)を有する高齢患者を対象とした17の臨床試験において、クエチアピン製剤を含む非定型抗精神病薬投与群はプラセボ投与群と比較して死亡率が1.6〜1.7倍高かったとの報告がある。また、外国での疫学調査において、定型抗精神病薬も非定型抗精神病薬と同様に死亡率の上昇に関与するとの報告がある。
イヌで長期大量(100mg/kg/日を6及び12ヵ月間)経口投与により、コレステロール合成阻害によると考えられる三角状後白内障が認められた。しかし、カニクイザル(最大225mg/kg/日を56週間)及びげっ歯類に投与しても白内障は認められなかった。また、臨床試験においても、クエチアピン製剤と関連した角膜混濁は認められなかった。
ラットに24ヵ月間経口投与したがん原性試験において、20mg/kg/日以上の雌の投与群で乳腺腫瘍の発現頻度の上昇が報告されている。これらの腫瘍の所見は、げっ歯類においてプロラクチンと関連した所見として報告されているが、ヒトではプロラクチン濃度の上昇と腫瘍形成の関連性は明確にされていない。
薬物動態
<生物学的同等性試験>
クエチアピン錠12.5mg「MEEK」
クエチアピン錠12.5mg「MEEK」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、クエチアピン錠25mg「MEEK」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた。1)
クエチアピン錠25mg「MEEK」
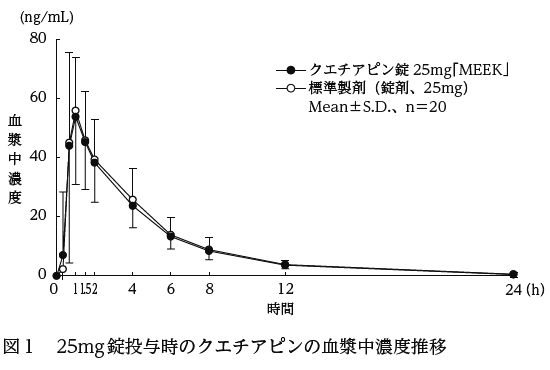
クエチアピン錠25mg「MEEK」と標準製剤を、クロスオーバー法によりそれぞれ1錠(クエチアピンとして25mg)健康成人男性に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.8)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された(図1、表1)。
2)
クエチアピン錠50mg「MEEK」
クエチアピン錠50mg「MEEK」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、クエチアピン錠25mg「MEEK」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた。3)
クエチアピン錠100mg「MEEK」
クエチアピン錠100mg「MEEK」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、クエチアピン錠25mg「MEEK」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた。2)
クエチアピン錠200mg「MEEK」
クエチアピン錠200mg「MEEK」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、クエチアピン錠25mg「MEEK」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた。2)
クエチアピン細粒50%「MEEK」
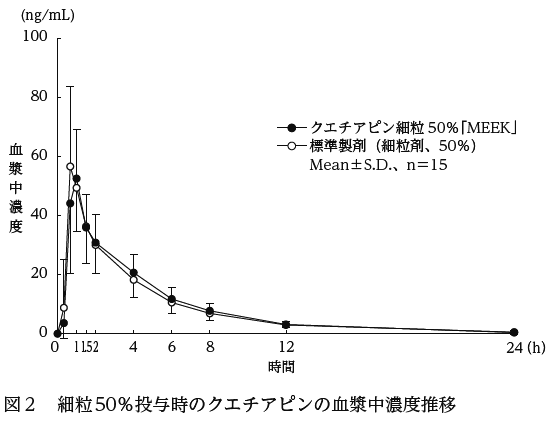
クエチアピン細粒50%「MEEK」と標準製剤を、クロスオーバー法によりそれぞれ50mg(クエチアピンとして25mg)健康成人男性に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.8)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された(図2、表2)。
4)
<溶出挙動>
クエチアピン錠12.5mg「MEEK」、クエチアピン錠25mg「MEEK」、クエチアピン錠50mg「MEEK」、クエチアピン錠100mg「MEEK」、クエチアピン錠200mg「MEEK」及びクエチアピン細粒50%「MEEK」は、日本薬局方医薬品各条に定められたクエチアピンフマル酸塩錠及びクエチアピンフマル酸塩細粒の溶出規格に適合していることが確認されている。5)
薬物動態の表
| 判定パラメータ | 判定パラメータ | 参考パラメータ | 参考パラメータ |
| AUC0→24h
(ng・h/mL) | Cmax
(ng/mL) | tmax
(h) | t1/2
(h) |
クエチアピン錠
25mg「MEEK」 | 241.34±78.42 | 63.88±28.30 | 1.1±0.4 | 4.0±3.0 |
標準製剤
(錠剤、25mg) | 251.60±92.22 | 62.28±18.96 | 1.0±0.4 | 3.9±1.2 |
| 判定パラメータ | 判定パラメータ | 参考パラメータ | 参考パラメータ |
| AUC0→24h
(ng・h/mL) | Cmax
(ng/mL) | tmax
(h) | t1/2
(h) |
クエチアピン細粒
50%「MEEK」 | 209.79±57.83 | 58.16±18.53 | 0.9±0.2 | 3.7±1.1 |
標準製剤
(細粒剤、50%) | 203.15±65.98 | 62.05±22.39 | 0.8±0.2 | 4.3±1.5 |
薬効薬理
セロトニン・ドパミン受容体遮断薬。定型抗精神病薬と同じくD2受容体拮抗作用を現すと共に、陰性症状に関与すると考えられるセロトニン5-HT2A受容体拮抗作用が加わることで、陰性症状にも効果を示す。非定型抗精神病薬とも呼ぶ。5)
有効成分に関する理化学的知見
一般名:クエチアピンフマル酸塩(Quetiapine Fumarate)
化学名:2-[2-(4-Dibenzo[
b,
f][1,4]thiazepin-11-ylpiperazin-1-yl)ethoxy]ethanol hemifumarate
分子式:(C21H25N3O2S)2・C4H4O4分子量:883.09
性 状:白色の粉末である。
メタノールにやや溶けにくく、水又はエタノール(99.5)に溶けにくい。
構造式: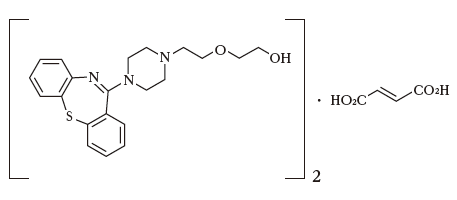
取扱い上の注意
使用期限内であっても、開封後はなるべく速やかに使用すること。
<安定性試験>
最終包装製品を用いた加速試験(40℃、75%RH、6ヵ月)の結果、クエチアピン錠12.5mg「MEEK」、クエチアピン錠25mg「MEEK」、クエチアピン錠50mg「MEEK」、クエチアピン錠100mg「MEEK」、クエチアピン錠200mg「MEEK」及びクエチアピン細粒50%「MEEK」は通常の市場流通下において3年間安定であることが推測された。7)
包装
クエチアピン錠12.5mg「MEEK」:100錠(PTP)
クエチアピン錠12.5mg「MEEK」:300錠(バラ)
クエチアピン錠25mg「MEEK」:100錠(PTP)
クエチアピン錠25mg「MEEK」:500錠(PTP)
クエチアピン錠25mg「MEEK」:500錠(バラ)
クエチアピン錠50mg「MEEK」:100錠(PTP)
クエチアピン錠50mg「MEEK」:500錠(バラ)
クエチアピン錠100mg「MEEK」:100錠(PTP)
クエチアピン錠100mg「MEEK」:500錠(PTP)
クエチアピン錠100mg「MEEK」:500錠(バラ)
クエチアピン錠200mg「MEEK」:100錠(PTP)
クエチアピン錠200mg「MEEK」:100錠(バラ)
クエチアピン細粒50%「MEEK」:100g(バラ)
主要文献及び文献請求先
主要文献
1
小林化工株式会社・社内資料(生物学的同等性試験)
2
竹内譲ほか:医学と薬学、68(5)、815(2012)
3
小林化工株式会社・社内資料(生物学的同等性試験)
4
小林化工株式会社・社内資料(生物学的同等性試験)
5
小林化工株式会社・社内資料(日本薬局方規格溶出試験)
6
第十七改正日本薬局方解説書
7
小林化工株式会社・社内資料(安定性試験)
文献請求先
主要文献欄に記載の文献・社内資料は下記にご請求下さい。
小林化工株式会社 安全管理部
〒919-0603 福井県あわら市矢地5-15

0120-37-0690 TEL 0776-73-0911
FAX 0776-73-0821
製造販売業者等の氏名又は名称及び住所
製造販売元
小林化工株式会社
福井県あわら市矢地5-15








 0120-37-0690 TEL 0776-73-0911
0120-37-0690 TEL 0776-73-0911