1
Vonderhaar, B.K.:Pharmacol. Ther. 1998;79(2):169-178
2
患者及び高齢者における血漿中濃度(セロクエル錠:2000年12月12日承認、申請資料概要へ.3.(2))
3
反復投与中の血漿中濃度(セロクエル錠:2000年12月12日承認、申請資料概要へ.3.(3).1))
4
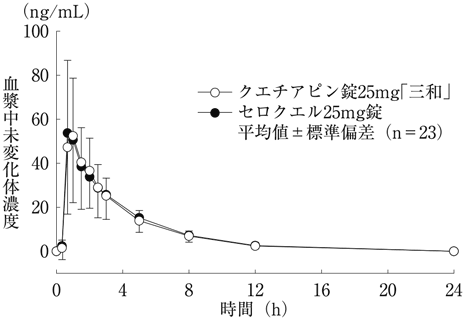
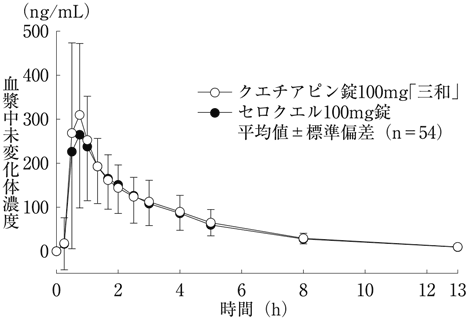
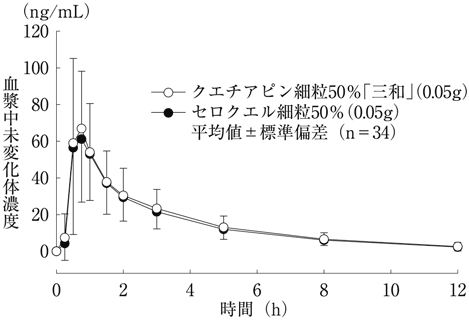
社内資料:生物学的同等性試験
5
クエチアピン代謝に関するP450アイソフォーム(セロクエル錠2000年12月12日承認、申請資料概要へ.3.(5).1))
6
肝障害の影響(セロクエル錠:2000年12月12日承認、申請資料概要へ.3.(3).4))
7
他剤がクエチアピンに及ぼす影響(セロクエル錠:2000年12月12日承認、申請資料概要へ.3.(6).2))
8
作用機序(セロクエル錠:2000年12月12日承認、申請資料概要ホ.1.(2).2))