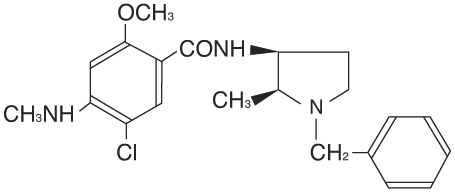
1
岡島詳泰 他:神経精神薬理. 1989;11(7):555-562[EM-010]
2
社内報告書:健康成人・薬物動態(D199200994-01. 00, 1989)
3
村崎光邦 他:薬理と治療. 1989;17(9):4347-4365[EM-005]
4
工藤義雄 他:臨床医薬. 1989;5(9):1813-1840[EM-002]
5
森 温理 他:臨床評価. 1989;17(3, 4):349-377[EM-008]
6
工藤義雄 他:臨床医薬. 1989;5(10):2149-2175[EM-003]
7
Terai, M. et al.:Eur. J. Pharmacol. 1989;173:173-182[EM-035]
8
Shibanoki, S. et al.:Pharmacol. Biochem Behav. 1989;34:355-360[EM-036]
9
社内報告書:ラット・薬理作用(D199200951-01. 00, 1989)
10
小林利雄 他:薬物・精神・行動. 1990;10:331-334[EM-037]
11
臼田眞治:薬学雑誌. 1987;107(9):711-719[EM-015]
12
越谷和雄 他:薬理と治療. 1989;17(6):2583-2587[EM-016]
13
臼田眞治 他:薬理と治療. 1990;18(10):3883-3906[EM-038]
14
Kuribara, H. et al.:Jpn. J. Pharmacol. 1990;52:489-492[EM-040]
15
Yamamoto, M. et al.:Neuropharmacology. 1982;21:945-951[EM-041]
16
Wanibuchi, F. et al.:Psychopharmacology. 1990;102:339-342[EM-039]
17
藤原 明 他:基礎と臨床. 1989;23(12):4433-4458[EM-021]