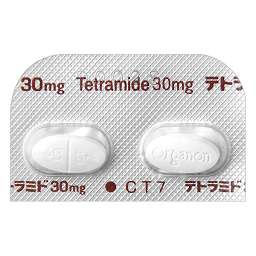
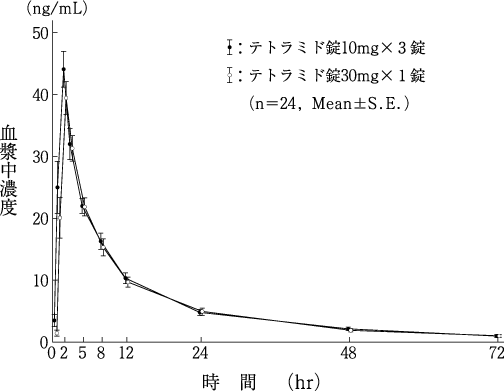
1
Buist A, et al. Br J Clin Pharmacol. 1993;36:133-4.
2
村崎光邦ほか. 臨床精神医学. 1988;17:553-64.
3
de Jongh GD, et al. Drug Metab Dispos. 1981;9:48-53.
4
上岡利春ほか. 日本薬理学雑誌. 1980;76:533-47.
5
van Riezen H, et al. Monogr Neural Sci. 1976;3:37-44.
6
Leonard BE. Psychopharmacologia. 1974;36:221-36.
7
Leonard BE, et al. Biochem Pharmacol. 1976;25:1939-42.
8
Kafoe WF, et al. Biochem Pharmacol. 1976;25:2455-60.
9
Baumann PA, et al. Naunyn Schmiedebergs Arch Pharmacol. 1977;300:31-7.
10
Goodlet I, et al. Br J Pharmacol. 1977;61:307-13.
11
Raiteri M, et al. J Pharm Pharmacol. 1976;28:483-8.
12
酒井豊ほか. 日本薬理学雑誌. 1980;76:213-25.
13
van Riezen H. Arch Int Pharmacodyn Ther. 1972;198:256-69.
14
Maj J, et al. Psychopharmacology. 1978;59:79-84.
15
酒井豊ほか. 日本薬理学雑誌. 1980;76:479-93.