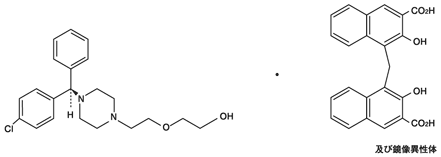
1
Zuidema, J.:Pharm Weekbl Sci. 1985;7(4):134-140
2
Moore, M. R. et al.:Clin Biochem. 1989;22(3):181-188
3
Parfitt, K.:Martindale The Complete Drug Reference 32nd ed. Pharmaceutical Press. 1999:397-401
4
Briggs, G. G. et al.:Drugs in Pregnancy and Lactation 10th ed. Lippincott Williams & Wilkins. 2015:675-677
5
Prenner, B. M.:Am J Dis Child. 1977;131(5):529-530
6
Sweetman, C.:Martindale The Complete Drug Reference 34th ed. Pharmaceutical Press. 2004:1492-1494
7
Salo, O. P. et al.:Acta Derm Venereol. 1986;66(4):349-350
8
Simons, F. E. R. et al.:J Allergy Clin Immunol. 1984;73(1 Pt 1):69-75
9
Close, J. A. et al.:Int Congr Ser. 1968;145:144-155
10
Pong, S. F. et al.:J Pharm Sci. 1974;63(10):1527-1532
11
長内 国臣ほか.:分娩と麻酔. 1967;21:13-18
12
Gengo, F. M. et al.:Clin Pharmacol Ther. 1987;42(3):265-272
13
Matzke, G. R. et al.:Ann Allergy. 1987;59(6 Pt 2):25-30
14
Simons, F. E. R. et al.:J Clin Pharmacol. 1989;29(9):809-815
15
Simons, K. J. et al.:Clin Pharmacol Ther. 1989;45(1):9-14
16
渡辺 繁紀ほか.:日本薬理学雑誌. 1974;70(1):19-37
17
Morren, H. G. et al.:Psychopharmacological Agents Gordon, M. ed. Vol.4. Academic Press. 1964:251-285
18
Levis, S. et al.:Arch Int Pharmacodyn Ther. 1957;109(1-2):127-142
19
Feinberg, A. R. et al.:J Allergy. 1958;29(4):358-361