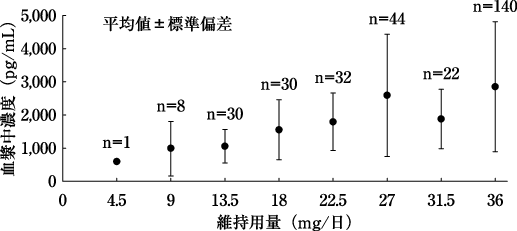
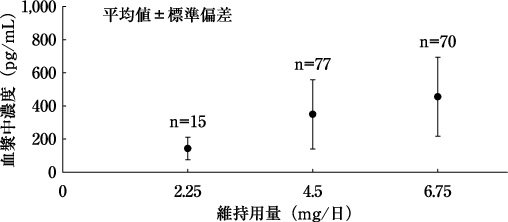
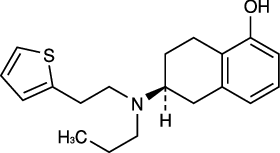
1
細木英司:社内資料(毒性試験). 2012.(2012年12月25日承認、CTD2.6.6)
2
Bird, H.:社内資料(ラットにおける乳汁移行). 2003.(2012年12月25日承認、CTD2.6.4.6)
3
Malik, M. et al.:Clin Pharmacol Ther. 2008;84(5):595-603.
4
細木英司:社内資料(安全性薬理試験). 2004.(2012年12月25日承認、CTD2.6.2.4)
5
Port, A.:社内資料(単回経皮投与試験). 2004.(2012年12月25日承認、CTD2.7.6.2)
6
Port, A.:社内資料(反復経皮投与試験). 2004.(2012年12月25日承認、CTD2.7.6.2)
7
金 盛烈:社内資料(薬物動態関連の統合解析). 2012.(2012年12月25日承認、CTD2.7.2.3)
8
Jacobus, J. D. T.:社内資料(異なる貼付部位における経皮投与試験). 2004.(2012年12月25日承認、CTD2.7.6.2)
9
Cawello, W. et al.:Drug Metab Dispos. 2009;37(10):2055-2060.
10
Schneider, A.:社内資料(各種動物血漿におけるたん白結合試験). 2001.(2012年12月25日承認、CTD2.6.4.4)
11
Hansen, K.:社内資料(ヒトSULT分子種同定試験). 2005.(2012年12月25日承認、CTD2.6.4.5)
12
Hansen, K.:社内資料(ヒトUGT分子種同定試験). 2005.(2012年12月25日承認、CTD2.6.4.5)
13
Eagling, V. A.:社内資料(ヒトCYP分子種同定試験). 2001.(2012年12月25日承認、CTD2.6.4.5)
14
Cawello, W. et al.:Clin Pharmacokinet. 2007;46(10):851-857.
15
Cawello, W. et al.:Br J Clin Pharmacol. 2012;73(1):46-54.
16
Cawello, W. et al.:Eur J Drug Metab Pharmacokinet. 2014;39(3):155-163.
17
Botha, F.:社内資料(オメプラゾールとの相互作用). 2007.(2012年12月25日承認、CTD2.7.6.2)
18
Waitzinger, J.:社内資料(シメチジンとの相互作用). 2003.(2012年12月25日承認、CTD2.7.6.2)
19
Braun, M. et al.:Br J Clin Pharmacol. 2009;67(2):209-215.
20
Braun, M. et al.:J Clin Pharmacol. 2009;49(9):1047-1055.
21
Braun, M. et al.:Br J Clin Pharmacol. 2009;68(3):386-394.
22
桑原和男:社内資料(L-dopa非併用パーキンソン病患者 第Ⅱ/Ⅲ相試験). 2011.(2012年12月25日承認、CTD2.7.6.4)
23
髙橋昌義:社内資料(L-dopa併用進行期パーキンソン病患者 第Ⅲ相試験). 2011.(2012年12月25日承認、CTD2.7.6.4)
24
井藤健介:社内資料(L-dopa非併用パーキンソン病患者 第Ⅱ/Ⅲ相試験の継続長期投与試験). 2011.(2012年12月25日承認、CTD2.7.6.4)
25
井藤健介:社内資料(L-dopa併用進行期パーキンソン病患者 第Ⅲ相試験の継続長期投与試験). 2012.(2012年12月25日承認、CTD2.7.6.4)
26
冨島さやか:社内資料(レストレスレッグス症候群患者 第Ⅲ相試験). 2011.(2012年12月25日承認、CTD2.7.6.5)
27
髙橋昌義:社内資料(レストレスレッグス症候群患者 後期第Ⅱ相試験の継続長期投与試験). 2011.(2012年12月25日承認、CTD2.7.6.5)
28
Wood, M. et al.:Br J Pharmacol. 2015;172(4):1124-1135.
29
Belluzzi, J. D.:社内資料(パーキンソン病サルモデルに関する試験1). 1988.(2012年12月25日承認、CTD2.6.2.2)
30
Belluzzi, J. D.:社内資料(パーキンソン病サルモデルに関する試験2). 1990.(2012年12月25日承認、CTD2.6.2.2)
31
Rose, S. et al.:Behav Pharmacol. 2007;18(2):155-160.