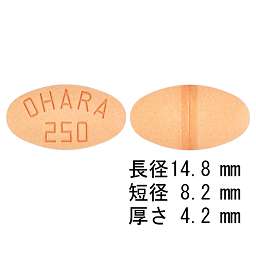
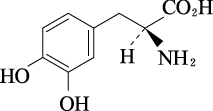
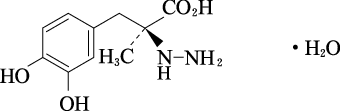
1
大本堯史他:基礎と臨床 1976;10(2):507-517
2
Ohmoto T, et al.:Folia Psychiatr Neurol Jpn. 1975;29(1):1-12
3
Maeda T, et al.:J Pharm Dyn. 1978;1:288-300
4
安藤一也他:日本医事新報 1977;No.2752:11-17
5
宮崎雄二:脳と神経 1975;27(6):621-628
6
加瀬正夫他:医学のあゆみ 1977;101(11):796-813
7
Hornykiewicz O:Pharmacol Rev. 1966;18(2):925-964
8
Cotzias GC, et al.:N Engl J Med. 1967;276(7):374-379
9
Porter CC, et al.:Biochem Pharmacol. 1962;11:1067-1077
10
Peck HM, et al.:社内資料
11
酒井 豊他:日本薬理学雑誌 1973;69(3):467-482
12
社内資料:l-DOPA(ドパストン)の概要
13
Goldstein M, et al.:Nature 1969;224(5217):382-384