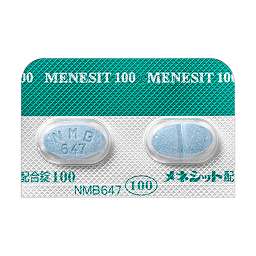
1
Ohmoto T, et al. Folia Psychiatr Neurol Jpn. 1975;29:1-12.
2
大本堯史、他. 基礎と臨床. 1976;10:507-17.
3
大本堯史、他. 脳と神経. 1975;27:225-33.
4
加瀬正夫、他. 医学のあゆみ. 1977;101:796-813.
5
Vickers S, et al. Drug Metab Dispos. 1974;2:9-22.
6
片岡喜由、他. 応用薬理. 1976;11:61-70.
7
Lotti V J, et al. J Pharmacol Exp Ther. 1970;172:406-15.
8
Lotti V J, et al. Eur J Pharmacol. 1974;25:322-5.
9
酒井豊、他. 日本薬理学雑誌. 1973;69:467-82.