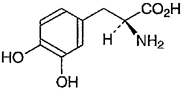
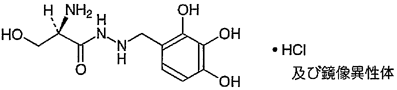
1
横地正之ほか:脳神経. 1979; 31: 339-348
2
兼田瑞穂ほか:薬理と治療. 1977; 5: 269-297
3
社内資料:一般臨床試験成績(1979年8月27日承認、申請資料概要X. 2))
4
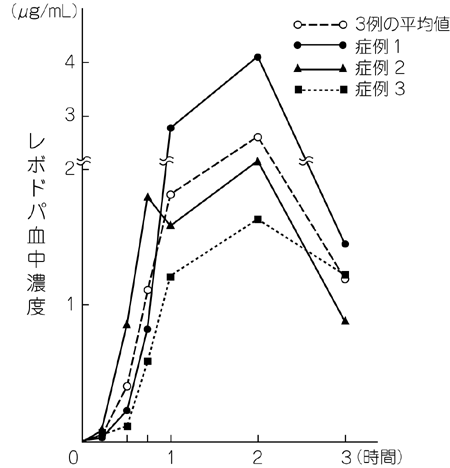
水野美邦ほか:神経進歩. 1977; 21: 807-834
5
Pletscher A, et al.:Schweiz Med Wochenschr. 1970; 100: 797-804
6
兼田瑞穂ほか:薬理と治療. 1977; 5: 243-253
パーキンソニズム治療剤
1錠 19.6円
有効成分 | 1錠中日局レボドパ 100mg、 ベンセラジドとして 25mg日局ベンセラジド塩酸塩 28.5mg |
|---|---|
添加剤 | カルメロースカルシウム、三二酸化鉄、ステアリン酸マグネシウム、タルク、乳糖水和物、バレイショデンプン |
| 直径(mm) | 9.1 |
|---|---|
| 厚さ(mm) | 3.5 |
| 重量(g) | 0.27 |
| 表面 | 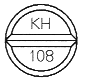 |
| 裏面 |  |
| 側面 |  |
| 色調 剤皮 | 淡赤色 素錠 |
| 識別コード | KH108 (錠剤本体、PTPシートに表示) |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
レセルピン製剤 テトラベナジン | 脳内ドパミンが減少し、本剤の作用が減弱するおそれがある。 | 脳内のドパミンを減少させてパーキンソン症状を悪化させる。 |
抗精神病薬 フェノチアジン系薬剤 クロルプロマジン等 ブチロフェノン系薬剤 ハロペリドール等 その他 ペロスピロン等 | 本剤の作用が減弱することがある。 | これらの薬剤によりドパミン受容体が遮断される。 |
パパベリン塩酸塩 | 本剤の作用が減弱するおそれがある。 | パパベリンが線条体でのドパミン受容体を遮断する可能性がある。 |
鉄剤 | 本剤の作用が減弱するおそれがある。 | キレートを形成し、本剤の吸収が減少するとの報告がある。 |
イソニアジド | 本剤の作用が減弱するおそれがある。 | 機序は不明であるが、イソニアジドによりドパ脱炭酸酵素が阻害されると考えられている。 |
血圧降下剤 メチルドパ水和物 レセルピン 節遮断剤等 | 本剤が血圧低下を増強することがある。 | レボドパに血圧降下作用があるためと考えられている。 |
他の抗パーキンソン剤 抗コリン剤 ブロモクリプチン アマンタジン等 | 精神神経系及び循環器系の副作用が増強することがある。 | 長期投与により大脳皮質におけるアセチルコリン系感受性が亢進する。 |
NMDA受容体拮抗剤 メマンチン塩酸塩等 | 本剤の作用を増強するおそれがある。 | これらの薬剤により、ドパミン遊離が促進する可能性がある。 |
全身麻酔剤 ハロタン等 | 不整脈を起こすおそれがある。 | 左記薬剤がカテコールアミンに対する心筋の感受性を増加させる。 |
5%以上 | 0.1~5%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|---|
精神神経系 | 不随意運動(顔面、口、頸部、四肢等) | 焦燥感、精神高揚、せん妄、不安、不眠、頭痛、頭重、めまい、眠気、筋緊張低下 | 突発性硬直、構音障害 | 傾眠、病的賭博、病的性欲亢進、ドパミン調節障害症候群 |
消化器 | 嘔気、嘔吐、食欲不振、口渇、便秘、腹痛、胃部不快感、下痢、胸やけ、口内炎、腹部膨満感 | 唾液分泌過多 | ||
泌尿器 | 排尿異常 | |||
血液 | 白血球減少 | |||
皮膚 | 発疹 | じん麻疹様湿疹、四肢色素沈着、口唇の水ぶくれ、脱毛 | ||
循環器 | 動悸、立ちくらみ、血圧低下 | 不整脈 | ||
眼 | 視覚異常 | |||
肝臓 | AST, ALT, Al-P上昇 | |||
その他 | 発汗、胸痛、脱力・倦怠感、浮腫 | のぼせ感 | 唾液・痰・口腔内粘膜・汗・尿・便等の変色(黒色等) |
レボドパ/ベンセラジド配合剤が優る | 同等である | レボドパが優る | |
全般改善度 | 48例 (53%) | 24例 (27%) | 18例 (20%) |
全般安全度 | 39例 (43%) | 34例 (38%) | 17例 (19%) |
全般有用度 | 53例 (59%) | 18例 (20%) | 19例 (21%) |