1
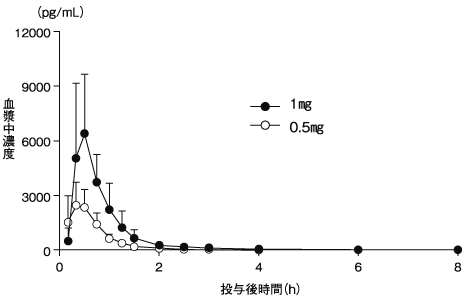
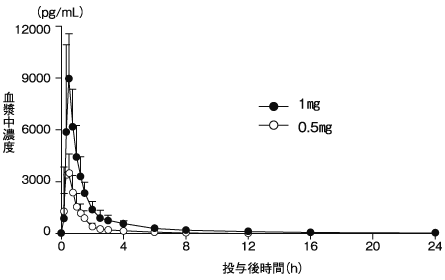
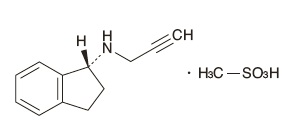
ラサギリンの臨床試験成績①(2018年3月23日承認、CTD 2.7.6.4)
2
ラサギリンの臨床試験成績②(2018年3月23日承認、CTD 2.7.6.2)
3
ラサギリンの臨床試験成績③(2018年3月23日承認、CTD 2.7.6.1)
4
ラサギリンの非臨床試験成績(2018年3月23日承認、CTD 2.6.4.1)
5
ラサギリンの臨床試験成績④(2018年3月23日承認、CTD 2.7.6.5)
6
ラサギリンの臨床試験成績⑤(2018年3月23日承認、CTD 2.7.2.3)
7
ラサギリンの臨床試験成績⑥(2018年3月23日承認、CTD 2.7.6.8)
8
ラサギリンの臨床試験成績⑦(2018年3月23日承認、CTD 2.7.6.6)
9
ラサギリンの臨床試験成績⑧(2018年3月23日承認、CTD 2.7.6.11)
10
ラサギリンの臨床試験成績⑨(2018年3月23日承認、CTD 2.7.6.9)
11
ラサギリンの臨床試験成績⑩(2018年3月23日承認、CTD 2.7.6.10)
12
ラサギリンの臨床試験成績⑪(2018年3月23日承認、CTD 2.7.6.14)
13
ラサギリンの臨床試験成績⑫(2018年3月23日承認、CTD 2.7.6.21)
14
ラサギリンの臨床試験成績⑬(2018年3月23日承認、CTD 2.7.6.29)
15
ラサギリンの臨床試験成績⑭(2018年3月23日承認、CTD 2.7.6.18)
16
ラサギリンの臨床試験成績⑮(2018年3月23日承認、CTD 2.7.6.26)
17
Youdim MB, et al. Br J Pharmacol. 2001;132:500-506.
18
Lamensdorf I, et al. J Neurochem. 1996;67:1532-1539.
19
Speiser Z, et al. J Neural Transm. Suppl. 1998;52:287-300.
20
Kupsch A, et al. J Neural Transm (Vienna). 2001;108:985-1009.