1
社内資料:長期反復投与毒性試験及びがん原性試験における肺の変化(2013年3月25日承認、CTD2.6.6.9.2.1)
2
社内資料:静脈内自己投与による強化効果の検索に関する試験(2013年3月25日承認、CTD2.6.6.8.3.2)
3
社内資料:長期反復投与毒性試験及びがん原性試験における脳の鉱質沈着(2013年3月25日承認、CTD2.6.6.9.2.4)
4
社内資料:ヘアレスラットを用いた光毒性試験(2013年3月25日承認、CTD2.6.6.8.4.1.2)
5
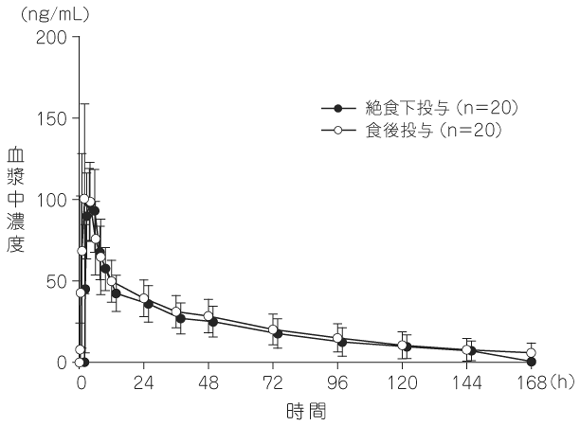
社内資料:単回投与時の薬物動態試験(国内・健康成人)(2013年3月25日承認、CTD2.7.6.2)
6
社内資料:反復投与時の薬物動態試験(国内・健康成人)(2013年3月25日承認、CTD2.7.6.6)
7
Brooks DJ, et al.: Synapse. 2008;62:671-681
8
社内資料:マスバランス試験(海外・健康成人)(2013年3月25日承認、CTD2.7.6.8)
9
社内資料:薬物動態試験(海外・腎機能低下患者)(2013年3月25日承認、CTD2.7.6.11)
10
社内資料:薬物動態試験(海外・肝機能低下患者)(2013年3月25日承認、CTD2.7.6.12)
11
社内資料:相互作用試験(海外・ミダゾラム/ケトコナゾール)(2013年3月25日承認、CTD2.7.6.14)
12
社内資料:相互作用試験(海外・リファンピシン)
13
社内資料:相互作用試験(海外・アトルバスタチン)(2013年3月25日承認、CTD2.7.6.15)
14
社内資料:相互作用試験(海外・ジゴキシン)(2013年3月25日承認、CTD2.7.6.16)
15
社内資料:薬物動態試験(海外・喫煙者)(2013年3月25日承認、CTD2.7.2.2.2.3)
16
社内資料:第Ⅲ相二重盲検試験(国内・パーキンソン病患者)(2013年3月25日承認、CTD2.7.6.20)
17
社内資料:アデノシン受容体に対する親和性(2013年3月25日承認、CTD2.6.2.2.2.1.1)
18
社内資料:アデノシンA2A受容体に対する機能試験(2013年3月25日承認、CTD2.6.2.2.2.1.4)
19
社内資料:黒質線条体片側破壊ラットにおける淡蒼球ガンマアミノ酪酸濃度測定(2013年3月25日承認、CTD2.6.2.2.2.2.2)
20
社内資料:マウスにおけるレセルピン誘発カタレプシー改善作用(2013年3月25日承認、CTD2.6.2.2.1.1)
21
社内資料:MPTP処置マーモセットに対する運動機能障害改善作用(2013年3月25日承認、CTD2.6.2.2.1.2.1)
22
社内資料:MPTP処置マーモセットにおけるレボドパとの併用効果(2013年3月25日承認、CTD2.6.2.2.1.2.3)
23
社内資料:MPTP処置マーモセットの不随意運動に対する作用(2013年3月25日承認、CTD2.6.2.2.1.2)