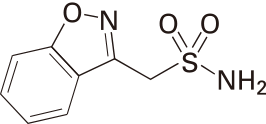
1
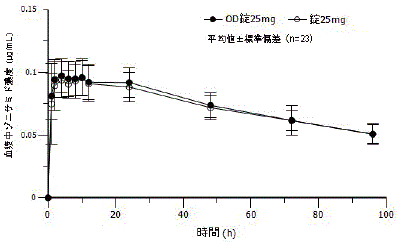
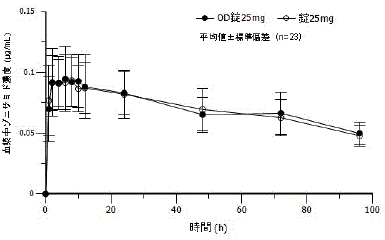
社内資料: OD錠25mgと錠25mgの生物学的同等性試験
2
Matsumoto K., et al.: Arzneim-Forsch./Drug Res. 1983; 33: 961-968
3
Ito T., et al.: Arzneim-Forsch./Drug Res. 1982; 32: 1581-1586
4
Nakasa H., et al.: Mol. Pharmacol. 1993; 44: 216-221
5
社内資料: ゾニサミドの腎機能障害患者における薬物動態
6
Murata M., et al.: Neurol. Clin. Neurosci. 2016; 4: 10-15
7
Murata M., et al.: Mov. Disord. 2015; 30: 1343-1350
8
社内資料: レビー小体型認知症患者対象臨床試験(第3相試験)(2018年7月2日承認、CTD2.7.6.2)
9
社内資料: 脳内ドパミンレベル増加作用及びMAO阻害作用(2009年1月21日承認、CTD2.6.2.2)
10
社内資料: チャネル阻害作用(2018年7月2日承認、CTD2.6.2.2)
11
社内資料: レボドパ作用の増強効果(2009年1月21日承認、CTD2.6.2.2)
12
社内資料: レボドパ作用の延長効果(2009年1月21日承認、CTD2.6.2.2)
13
社内資料: 実験的wearing-off現象の改善効果(2009年1月21日承認、CTD 2.6.2.2)