1
臨床薬理試験(二重盲検クロスオーバー法による用量探索試験)(コムタン錠:2007年1月26日承認、申請資料概要 2.7.2.2.3.1.1、2.7.6.4.2)
2
薬物動態及び忍容性の検討(二重盲検、プラセボ対照、クロスオーバー試験)(コムタン錠:2007年1月26日承認、申請資料概要 2.7.6.4.2)
3
薬物動態に関する民族間での比較(コムタン錠:2007年1月26日承認、申請資料概要 2.5.3.1.7)
4
健康成人における臨床第Ⅰ相試験(単回経口投与)(コムタン錠:2007年1月26日承認、申請資料概要 2.7.6.3.1)
5
健康成人における臨床第Ⅰ相試験(連続経口投与)(コムタン錠:2007年1月26日承認、申請資料概要 2.7.6.3.1)
6
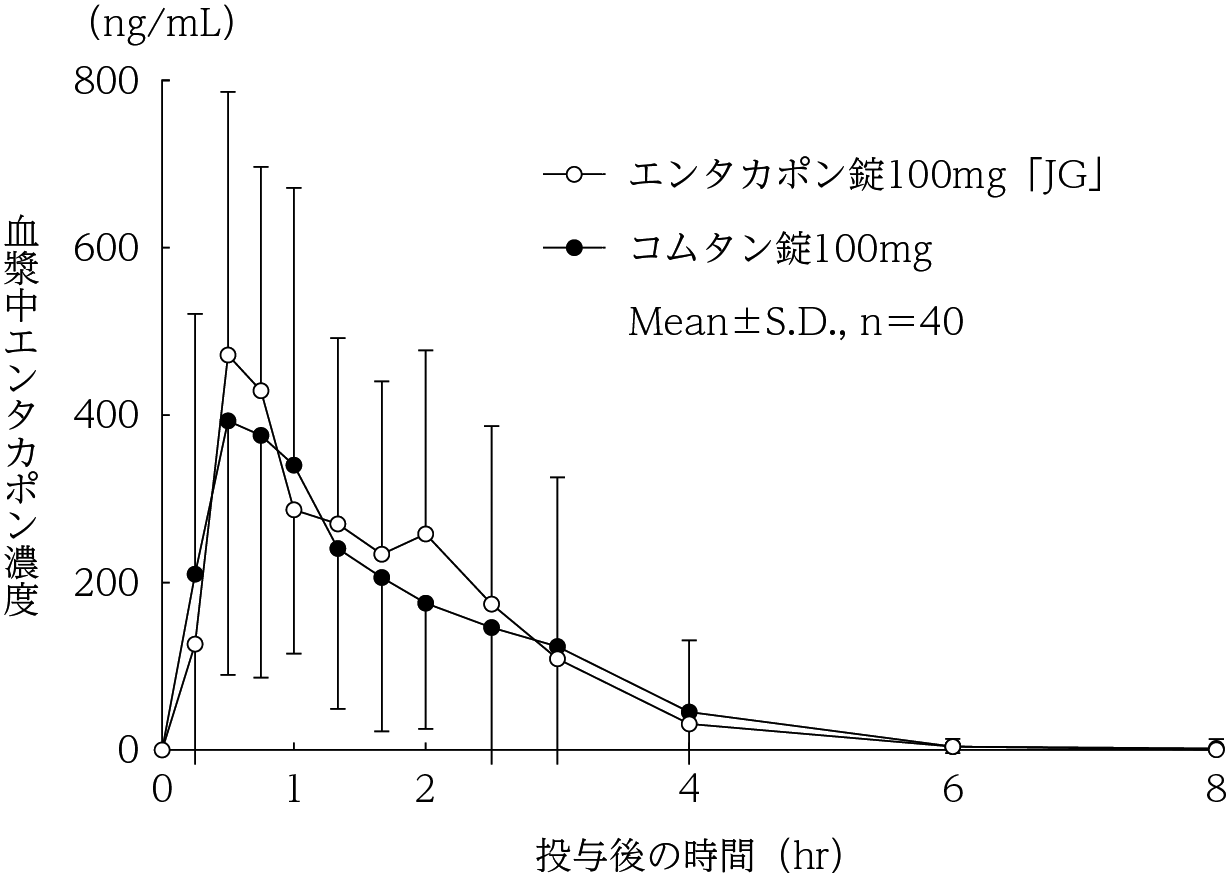
社内資料:生物学的同等性試験
7
バイオアベイラビリティー試験(コムタン錠:2007年1月26日承認、申請資料概要 2.7.6.1.1)
8
薬物動態に及ぼす食事の影響(コムタン錠:2007年1月26日承認、申請資料概要 2.7.6.3.1)
9
血漿蛋白結合率(コムタン錠:2007年1月26日承認、申請資料概要 2.6.4.4(3))
10
分布(コムタン錠:2007年1月26日承認、申請資料概要 2.7.2.3.5)
11
代謝(コムタン錠:2007年1月26日承認、申請資料概要 2.5.3.1.3)
12
チトクロームP450分子種活性への影響(コムタン錠:2007年1月26日承認、申請資料概要 2.6.4.5(4))
13
腎機能障害患者における薬物動態(コムタン錠:2007年1月26日承認、申請資料概要 2.7.6.3.2)
14
肝機能障害患者における薬物動態(コムタン錠:2007年1月26日承認、申請資料概要 2.7.6.3.2)
15
健康高齢者及び若年成人における薬物動態(コムタン錠:2007年1月26日承認、申請資料概要 2.7.6.3.1)
16
Mizuno, Y. et al.:Mov. Disord. 2007;22(1):75-80
17
国内後期第Ⅱ相試験(コムタン錠:2007年1月26日承認、申請資料概要 2.7.6.4.1)
18
Rinne, U.K. et al.:Neurology. 1998;51(5):1309-1314
19
海外第Ⅲ相試験(コムタン錠:2007年1月26日承認、申請資料概要 2.7.6.4.1)
20
Parkinson Study Group:Ann. Neurol. 1997;42(5):747-755
21
海外第Ⅲ相試験(コムタン錠:2007年1月26日承認、申請資料概要 2.7.6.4.1)
22
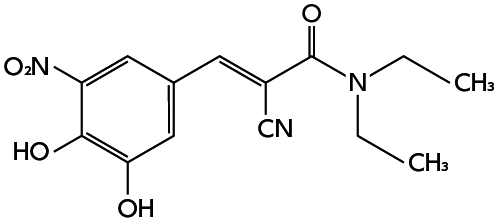
作用機序(コムタン錠:2007年1月26日承認、申請資料概要 2.6.2.6)
23
COMT阻害作用(in vitro)(コムタン錠:2007年1月26日承認、申請資料概要 2.6.2.2(1)1)、2.6.2.2(1)2))
24
末梢COMT及び線条体COMT阻害作用(ex vivo)(コムタン錠:2007年1月26日承認、申請資料概要 2.6.2.2(2)1))
25
血清レボドパ及び3-O-メチルドパ濃度ならびに線条体ドパミン量に対する作用(コムタン錠:2007年1月26日承認、申請資料概要 2.6.2.2(2)2)、2.6.2.2(3)2))
26
レセルピン処置マウスの運動活性に対する作用(コムタン錠:2007年1月26日承認、申請資料概要 2.6.2.2(5)1))
27
片側ドパミン神経破壊ラットの回転行動に対する作用(コムタン錠:2007年1月26日承認、申請資料概要 2.6.2.2(5)2))
28
MPTP処置マーモセットの運動活性及び運動機能障害に対する作用(コムタン錠:2007年1月26日承認、申請資料概要 2.6.2.2(5)3))