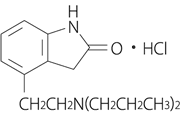
1
Tompson D,et al.:Clin Ther.2007;29:2654-2666
2
浦江明憲ら:薬理と治療.1996;24:S1805-S1815
3
Fukuzaki K,et al.:Pharmacol Biochem Behav.2000;67:121-129
4
Fukuzaki K,et al.:Pharmacol Biochem Behav.2000;65:503-508
徐放性ドパミンD2受容体系作動薬
1錠 478.7円
有効成分 | 1錠中 ロピニロールとして2.00mgロピニロール塩酸塩2.28mg |
|---|---|
添加剤 | ヒプロメロース、乳糖水和物、グリセリン脂肪酸エステル、D-マンニトール、カルメロースナトリウム、硬化油、ポビドン、デキストリン、ステアリン酸マグネシウム、軽質無水ケイ酸、黄色三二酸化鉄、酸化チタン、マクロゴール400、三二酸化鉄 |
有効成分 | 1錠中 ロピニロールとして8.00mgロピニロール塩酸塩9.12mg |
|---|---|
添加剤 | ヒプロメロース、乳糖水和物、グリセリン脂肪酸エステル、D-マンニトール、カルメロースナトリウム、硬化油、ポビドン、デキストリン、ステアリン酸マグネシウム、軽質無水ケイ酸、黄色三二酸化鉄、酸化チタン、マクロゴール400、三二酸化鉄、黒酸化鉄 |
| 剤形・性状 | 淡紅白色のフィルムコーティング錠 |
|---|---|
| 識別コード | GS 3V2 |
| 表 (長径×短径) |  12.6mm×6.9mm |
| 裏 |  |
| 側面 (厚さ) |  6.4mm |
| 質量 | 474mg |
| 剤形・性状 | 赤褐色のフィルムコーティング錠 |
|---|---|
| 識別コード | GS 5CC |
| 表 (長径×短径) |  12.6mm×6.9mm |
| 裏 |  |
| 側面 (厚さ) |  6.4mm |
| 質量 | 474mg |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
ドパミン拮抗剤 抗精神病薬 メトクロプラミド スルピリド等 | 本剤の作用が減弱することがある。 | 本剤はドパミン作動薬であり、併用により両薬剤の作用が拮抗するおそれがある。 |
CYP1A2阻害作用を有する薬剤 シプロフロキサシン フルボキサミン等 | ロピニロール速放錠とシプロフロキサシンとの併用によりロピニロールのCmax及びAUCがそれぞれ約60%及び84%増加したことが報告されている。 本剤投与中にこれらの薬剤を投与開始又は中止する場合は、必要に応じて本剤の用量を調整すること。 | これらの薬剤のCYP1A2阻害作用により、本剤の血中濃度が上昇する可能性がある。 |
エストロゲン含有製剤 | 高用量のエストロゲンを投与した患者でロピニロールの血中濃度上昇がみられたとの報告があるので、本剤投与中に高用量のエストロゲンを投与開始又は中止する場合は、必要に応じて本剤の用量を調整すること。 | 機序不明 |
他の抗パーキンソン剤 | ジスキネジア、幻覚、錯乱等の副作用が発現しやすくなる可能性があるため、これらの副作用があらわれた場合には減量、休薬又は投与中止等の適切な処置を行うこと。 | 機序不明 |
5%以上 | 5%未満 | 頻度不明 | |
|---|---|---|---|
過敏症 | 発疹、瘙痒 | 蕁麻疹、血管性浮腫等 | |
精神系 | リビドー亢進 | 病的賭博、強迫性購買、暴食、攻撃性、躁状態 | |
神経系 | 傾眠、ジスキネジア | めまい | 失神 |
血管障害 | 起立性低血圧 | 低血圧 | |
胃腸障害 | 悪心、便秘 | 腹痛、嘔吐、消化不良 | |
その他 | 末梢性浮腫 | 薬剤離脱症候群注)(無感情、不安、うつ、疲労感、発汗、疼痛等) |
投与量(mg) | 例数(例) | トラフ濃度(ng/mL) |
2 | 61 | 1.81±1.76 |
4 | 58 | 3.53±1.75 |
6 | 1 | 3.82 |
8 | 61 | 7.60±5.51 |
10 | 17 | 9.77±3.24 |
12 | 12 | 11.97±7.21 |
14 | 9 | 12.58±5.59 |
16 | 12 | 15.47±8.29 |
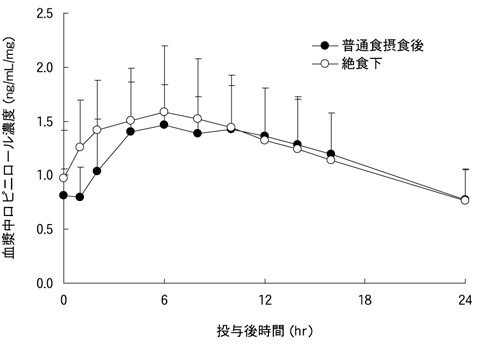
投与条件 | Cmax(ng/mL/mg) | AUC0-24(ng・hr/mL/mg) |
摂食後 | 1.63±0.46 | 28.28±7.88 |
絶食下 | 1.64±0.61 | 28.91±10.37 |
投与量(mg) | ロピニロール | 主代謝物(脱プロピル体) | 合計 |
0.1 | 6.4±2.9 | 35.3±11.2 | 41.7±12.1 |
0.2 | 9.7±5.8 | 40.3±13.9 | 50.0±13.2 |
0.4 | 3.3±0.9 | 39.3±6.4 | 42.6±6.5 |
投与群 | 例数 | ベースライン | 調整済み減少度 | 95%信頼区間注) |
レキップCR錠 | 141 | 24.1 | -10.8 | -1.41, 2.09 |
レキップ錠 | 133 | 24.3 | -11.1 |
評価項目 | 投与群 | 例数 | 結果 | |
UPDRS PartⅢ レスポンダー率注1) | レキップCR錠 | 151 | 81% | |
レキップ錠 | 139 | 78% | ||
UPDRS PartⅡ 合計点 | レキップCR錠 | 151 | ベースライン | 7.7 |
減少度(on時) | -2.6 | |||
レキップ錠 | 142 | ベースライン | 7.6 | |
減少度(on時) | -2.9 | |||
改善率 | レキップCR錠 | 151 | 63% | |
レキップ錠 | 142 | 61% | ||
off時間の短縮注2) | レキップCR錠 | 78 | 76% | |
レキップ錠 | 77 | 69% | ||
レキップ錠1日投与量(mg) | レキップCR錠1日投与量(mg) |
3 | 4 |
4.5 | 4 |
6 | 6 |
7.5 | 8 |
9 | 8 |
10.5 | 10 |
12 | 12 |
13.5 | 14 |
15 | 16 |
評価項目 | 例数 | ベースライン | 減少度 |
UPDRS PartⅡ合計点 | 62 | 8.2 | -3.9 |
UPDRS PartⅢ合計点 | 62 | 22.4 | -11.3 |