1
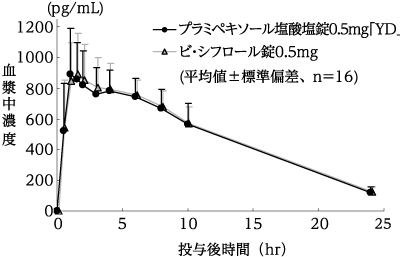
(株)陽進堂社内資料:生物学的同等性試験(錠0.5mg)
2
(株)陽進堂社内資料:生物学的同等性試験(錠0.125mg)
3
Mierau, J. et al.:Eur. J. Pharmacol. 1995;290:29-36
4
Mierau, J.:Clin. Neuropharmacol. 1995;18(1):S195-206
5
Domino, E. F. et al.:Eur. J. Pharmacol. 1997;325:137-144
6
ハロペリドール誘発カタレプシーに対する改善作用(ビ・シフロール錠:2003年10月16日承認、申請資料概要ホ.Ⅰ.3.(2))







 0120-647-734
0120-647-734

