1
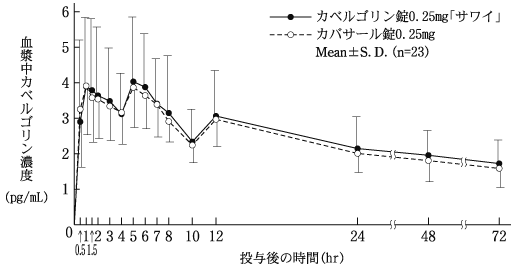
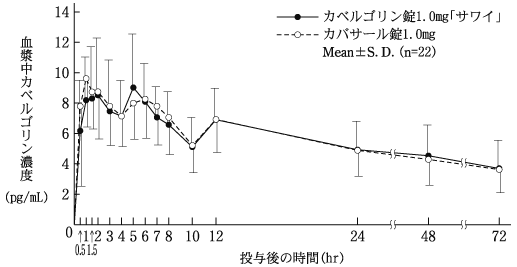
外国健康成人における単回投与時の薬物動態(カバサール錠:2003年4月16日承認、申請資料概要ヘ.3.1.1)
2
陶易王他:診療と新薬, 2007;44(5):485-496
3
Nakamura, S. et al.:薬物動態, 1996;11(4):331-346
4
Battaglia, R. et al.:Xenobiotica, 1993;23(12):1377-1389
5
柳澤信夫他:臨床医薬, 1996;12(10):2063-2091
6
柳澤信夫他:臨床医薬, 1996;12(17):3665-3718
7
柳澤信夫他:臨床医薬, 1996;12(17):3719-3755
8
柳澤信夫他:臨床医薬, 1996;12(17):3757-3798
9
柳澤信夫他:臨床医薬, 1996;12(17):3799-3823
10
田代邦雄他:臨床医薬, 1996;12(17):3825-3846
11
柳澤信夫他:臨床医薬, 1996;12(17):3847-3871
12
水野美邦他:臨床医薬, 1996;12(17):3873-3892
13
古和久幸他:臨床医薬, 1996;12(17):3893-3923
14
試験別・背景因子別全般改善度(高プロラクチン血症)(カバサール錠:2003年4月16日承認、申請資料概要ト.2.1)
15
試験別・副作用の種類別発現頻度一覧表(カバサール錠:2003年4月16日承認、申請資料概要ト.2.2.2)
16
試験別臨床検査値・理学検査異常変動一覧表(カバサール錠:2003年4月16日承認、申請資料概要ト.2.2.3)
17
高プロラクチン血症患者及び乳汁漏出症患者における前期第Ⅱ相臨床試験(カバサール錠:2003年4月16日承認、申請資料概要ト.1.2.1)
18
高プロラクチン血症患者及び乳汁漏出症患者における後期第Ⅱ相臨床試験(カバサール錠:2003年4月16日承認、申請資料概要ト.1.2.2)
19
武谷雄二他:産科と婦人科, 2003;70(6):830-843
20
武谷雄二他:産科と婦人科, 2003;70(8):1125-1137
21
高プロラクチン血症患者及び乳汁漏出症患者における国内長期臨床試験(カバサール錠:2003年4月16日承認、申請資料概要ト.1.2.4)
22
試験別・背景因子別総合臨床効果(産褥性乳汁分泌抑制)(カバサール錠:2003年4月16日承認、申請資料概要ト.2.1)
23
産褥性乳汁分泌抑制を必要とする患者における前期第Ⅱ相臨床試験(カバサール錠:2003年4月16日承認、申請資料概要ト.1.3.1)
24
産褥性乳汁分泌抑制を必要とする患者における後期第Ⅱ相臨床試験(カバサール錠:2003年4月16日承認、申請資料概要ト.1.3.2)
25
武谷雄二他:産科と婦人科, 2003;70(7):965-978
26
第十八改正日本薬局方解説書, 廣川書店, 2021;C-1346-1352
27
Miyagi, M. et al.:Biol. Pharm. Bull., 1996;19(9):1210-1213
28
Arai, N. et al.:J. Neural. Transm. Park. Dis. Dement. Sect., 1995;10(1):55-62
29
Miyagi, M. et al.:Biol. Pharm. Bull., 1996;19(11):1499-1502
30
Arai, N. et al.:J. Neural. Transm., 1996;103(11):1307-1316
31
衣川眞弓他:基礎と臨床, 1996;30(10):2525-2530
32
Moro, M. et al.:Eur. J. Pharmacol., 1999;368(1):57-66
33
乳汁分泌抑制作用(カバサール錠:2003年4月16日承認、申請資料概要ホ.1.1.3)
34
高プロラクチン血性排卵障害に対する作用(カバサール錠:2003年4月16日承認、申請資料概要ホ.1.1.5)
35
プロラクチン産生下垂体腺腫に対する作用(カバサール錠:2003年4月16日承認、申請資料概要ホ.1.1.4)
36
浅利哲也他:基礎と臨床, 1996;30(10):2531-2537