1
Lees A.J. et al.:Br Med J. 1995;311:1602-1607
2
Ben-Shlomo Y. et al.:Br Med J. 1998;316:1191-1196
3
Thorogood M. et al.:Br Med J. 1998;317:252-254
4
Olanow C.W. et al.:Neurology. 1998;51:825-830
5
Donnan P.T. et al.:Neurology. 2000;55:1785-1789
6
尾野敏雄 他:臨床医薬. 1991;7:1475-1498
7
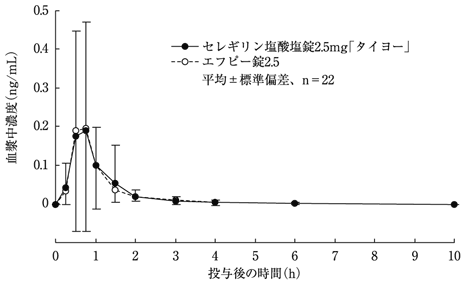
社内資料:生物学的同等性試験
8
近藤智善 他:医学のあゆみ. 1996;177:157-231
9
Mizuno Y. et al.:Clin Neuropharm. 2017;40:201-207
10
国内第Ⅲ相試験(エフピーOD錠;2015年12月21日承認、審査報告書)
11
Mizuno Y. et al.:Clin Neuropharm. 2019;42:123-130
12
国内第Ⅲ相継続長期投与試験(エフピーOD錠;2015年12月21日承認、審査報告書)
13
Yang H.Y.T. et al.:J Pharmacol Exp Ther. 1973;187:365-371
14
Yang H.Y.T. et al.:J Pharmacol Exp Ther. 1974;189:733-740
15
伊藤芳久 他:わかりやすい薬理学(第10版). 2016;163-164
16
Knoll J.:Ed by N.S.Shah & A.G.Donald:"Movement Disorders chapter2" Plenum Publishing Corp. 1986;53-81
17
Zsilla G. et al.:Pol J Pharmacol Pharm. 1986;38:57-67
18
Shimazu S. et al.:Jpn Pharmacol Ther. 1997;25:955-963
19
Kaseda S. et al.:Brain Res. 1999;815:44-50
20
Heikkila R.E. et al.:Nature. 1984;311:467-469
21
Cohen G. et al.:Eur J Pharmacol. 1984;106:209-210
22
Harsing L.G. et al.:Pol J Pharmacol Pharm. 1979;31:297-307