1
Yen, T. T. et al.:Life Sciences, 1979;25:209-216
2
Rubin, A. et al.:Clin. Pharmacol. Ther., 1981;30:258-265
3
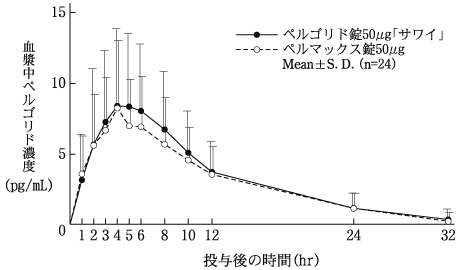
社内資料:生物学的同等性試験(錠50μg)
4
江角凱夫他:薬物動態, 1992;7:61-69
5
社内資料:生物学的同等性試験(錠250μg)
6
楢林博太郎他:臨床医薬, 1991;7:151-192
7
楢林博太郎他:医学と薬学, 1992;27:471-534
8
楢林博太郎他:医学と薬学, 1992;27:147-211
9
Wong, D. T. et al.:Arz-Forsch., 1993;43:409-412
10
Koller, W. C. et al.:Neuropharmacology, 1980;19:831-837
11
Clemens, J. A. et al.:Arz-Forsch., 1993;43:281-286
12
Duvoisin, R. C. et al.:Neurology, 1982;32:1387-1391
13
Goldstein, M. et al.:Adv. Neurol., 1979;24:247-252
14
Felten, D. L. et al.:Neurobiol. Aging, 1992;13:339-351
15
Fuller, R. W. et al.:Life Sciences, 1979;24:375-382